[video-1]
Değerli Toksikoloji takipçileri;
olarak Temel ve İleri Toksikoloji kursumuzu Ankara Üniversite Tıp Fakültesi Acil Tıp Anabilim Dalı'ında 17 farklı şehirden, Acil Tıp dışında pediatri uzmanları'da olmak üzere 34 katılımcı ile başarıyla tamamladık.
Toksikoloji konularında otör eğitmenlerimiz ve güçlü kadromuz (http://tatdtoksikoloji.org/etkinlik/toksikoloji-kursu-ankara) ve katılımcılarımız başta olmak üzere;
Kurs koordinatörümüz Prof.Dr.Arzu Denizbaşı’na, Lokal koordinatörümüz Uzm.Dr.Bulut Demirel’e, Kursumuzun sıcak bir ortamda geçmesi ve bizlere ev sahipliği yapan Doç.Dr.Müge Günalp Eneyli’e teşekkür ederiz.
TATD Toksikoloji çalışma grubu için; bizi twitter'da takip edebilir (@tatdtoksikoloji) ve görüşlerinizi bizimle (www.tatdtoksikoloji.org ve tatdtoksikoloji@gmail.com) paylaşabilirsiniz.
Saygılarımızla
Türkiye Acil Tıp Derneği
Toksikoloji Çalışma Grubu adına

Değerli Acil Tıp Uzmanları;
Üzerinde çalıştığımız projemiz “TOXIPAPER” hayata geçiyor.
Editörlerimiz ve çalışma grubu üyelerimiz her ay güncel, merak edilen ve günlük hayatımızda etkileri olacak makaleleri sizler için derleyip aylık yazılara haline getirecek ve bu yazılar sizlerin takibine sunulacak.
Umarım bu projede her zaman ki enerjinizle bizimle beraber yol almaya,tartışmalara aktif katılmaya ve günlük hayatımızda toksikoloji literatürünü takip devam etmeye hazırsınızdır.
Hazırsanız 15 Aralık 2017 tarihinde bu uzun ömürlü maratona başlıyoruz.
Her birinize şimdiden ilginiz için teşekkür ediyoruz.
Saygılarımızla
Türkiye Acil Tıp Derneği
Toksikoloji Çalışma Grubu adına
Değerli Arkadaşlar,
Bildiğiniz üzere Toksikoloji’nin Acil Tıp Anabilim Dalına Yan Dal olma süreci başladı.
Öncelikle bu eğitimi vermeyi hedefleyen üniversitelerde akademik teşkilat yönetmeliği doğrultusunda Toksikoloji bilim dalı kurulıuş aşamasında Acil Tıp AD başkanları tarafından Toksikoloji bilim dalının açılmasının gerekçelerini içeren bir gerekçe metni hazırlanmalıdır.
Bu gerekçe metninde, Toksikoloji Yan Dal eğitiminin bahsi geçecek klinikte; neden başlaması gerektiği, bu klinikteki toksikoloji hasta potansiyeli, bu eğitimin kliniğe ve topluma olacak olan potansyel faydalarının neler olduğunun detaylı bir şekilde yazılması beklenmektedir. Verilen verilerin istatistiki verilerle desteklenmesi iyi olacaktır.
Gerekçe metni; bölüm başkanı ve dekanın ortak görüşü alınarak Üniversite Senatosunda görüşülmek üzere Rektörlüğe gönderilecektir. Sonrasında Üniversite Senatosunun uygun görüşü ile Yüksek Öğretim Kurumu’nun onayına sunulacaktır. Program kabulunden sonra TUK Yan dal asistan kadrolarını belirleyecektir.
Bilim dalı kurulduktan sonraki süreçte Toksikoloji Bilim dalı başkanı, bilim dalında varsa profesörleri, bulunmadığı takdirde doçentleri, bulunmadığı takdirde yardımcı doçentleri, yardımcı doçent de bulunmadığı taktirde öğretim görevlileri arasından, bilim dalında görevli öğretim üyeleri ve öğretim görevlilerince seçilir ve bir hafta içinde dekan tarafından atanır.
Toksikoloji Yan Dalı kurulması için aday olan klinikler bünyesindeki eğitici adayı olan kişilerin özgeçmişlerinin, toksikoloji alanındaki tecrübelerinin, toksikoloji eğitici belgeleri ve sertifikalarının ibraz edilmesi önemlidir.
Bilim dalı kurulu, o bilimdalında görevli profesör, doçent, yardımcı doçent ile öğretim görevlilerinden oluşur. Bilim dalı kurulu, ders programlarının, araştırmaların hazırlanma ve uygulamaları ile ilgili önerilerini bilim dalı başkanına sunar.
Eğer bahsi geçen anabilim dallarında yeterli sayıda eğitici yok ise, Farmakoloji veya Adli Tıp anabilim dallarından öğretim üyesi desteği istenebilir.
Konu ile ilgili daha detaylı bilgiye ve mevzuata, tıpta uzmanlık kurulunun (TUK) internet sitesinden ulaşabilirsiniz.
Bu sürecin acil tıbba, toksikolojiye ve dolayısıyla toplum sağlığına katkı sağlayacağını düşünmekteyiz.
Prof. Dr. Arzu Denizbaşı
Toksikoloji Çalışma Grubu Başkanı

64 yaşında erkek hasta, inşaatta çalışırken kazara, yapıştırıcı olarak kullanılan bir materyalden az miktarda içme sebebiyle 112 ile kliniğimize getirildi. Geldiğinde bilinci açık, koopere, vital bulguları stabil idi. İçtikten hemen sonra başlayan boğazda ve sternum arkasında yanma, bulantı-kusma şikayeti mevcuttu. Fizik muayenesinde orofarinks hiperemik ve epigastrik bölgede hassasiyeti vardı. Acil servise ilk gelişi anında alınan tetkiklerinde herhangi bir patoloji saptanmadı.
Koroziv madde alımı öntanısıyla acil serviste tetkik ve tedavi altına alınan hastanın içtiği sıvının Metil Etil Keton Peroksit olduğu öğrenildi.

1. Metil Etil Keton Peroksit nedir?Metil etil keton peroksit(MEKP), solvent olarak kullanılan oldukça toksik bir maddedir. Berrak renksiz bir sıvıdır. Bu nedenle su ile karıştırılıp kazara alımlarına rastlanılabilmektedir. Güçlü bir oksitleyici ajan ve aşındırıcıdır (koroziv). MEKP, reçineler sentetik kauçuk ve diğer petrokimyasal plastik üretiminde sertleştirici olarak kullanılır. 2. Nasıl bir zehirlenme tablosuna yol açar?MEKP diğer koroziv maddelerden farklı olarak, koroziv özefajit bulgularına ek olarak çoklu organ yetmezliği sonucunda ölüme sebebiyet verebilen bir maddedir. MEKP maruziyeti, serbest radikal oluşumuna yol açar ve bu durum lipit peroksidasyonuyla sonuçlanır. Lipit peroksidasyonu ise hücre düzeyinde fonksiyon bozukluğuna, özellikle karaciğer yetmezliği ve çoklu organ yetmezliğine neden olabilmektedir. MEKP başlıca akut dönemde hepatosit nekrozuna bağlı karaciğer yetmezliği, böbrek yetmezliği, ciddi metabolik asidoz, koroziv etkisine sekonder ise orofarinks, havayolu ve larinkste ödem, inhalasyon pnömonisi, gastrointestinal sistemde (GİS) koroziv özefajit, GİS kanaması, perforasyona neden olarak morbidite ve mortaliteye yol açmaktadır. Kronik dönemde ise koroziv etkisine bağlı olarak gastrointestinal sistemin çeşitli bölümlerinde çok ağır striktürler gelişebilmektedir. MEKP insanda küçük miktarda alımlarda bile toksiktir, ancak ölümcül limitin 50-100 ml olduğu varsayılmaktadır. |

3. MEKP maruziyeti sonrası neden Bilgisayarlı Tomoğrafi (BT) görüntüleme yapılmalıdır?
Genel olarak en sık rastlanılan klinik koroziv özefajit, gastrit ve hepatik nekrozdur. Klasik olarak koroziv özefajitin geleneksel tanı yöntemi endoskopidir. Fakat bu hastalarda BT transmural hasar konusunda endoskopiden daha çok bilgi verici olmaktadır. BT görüntüleme tüm gastrointestinal sistem hakkında bilgi verdiği gibi, perforasyonun ekarte edilmesinde oldukça faydalıdır.
Bizim vakamızın BT görüntülemesinde: Özefagus duvarlarında tüm düzeylerde mevcut diffüz kalın heterojen görünüm ve duvar içi hava dansitelerinde belirginleşme, duvar kalınlığında artış izlenmektedir. Ayrıca mevcut tetkikte hiatus düzeyinde hemen duvar lateralinde noktasal hava dansiteleri ve paraözefageal sıvı dansiteleri mevcuttur. İntrahepatik safra yollarında multpl sayıda yaygın hava dansiteleri (pnömobilia) izlenmektedir. Şekil 1 de MEKP maruziyeti sonrası BT görüntüleme de tespit edilen pnomobilia bulgusu gösterilmiştir.
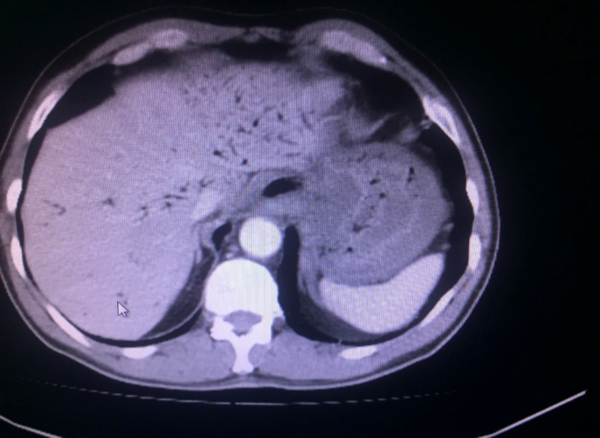 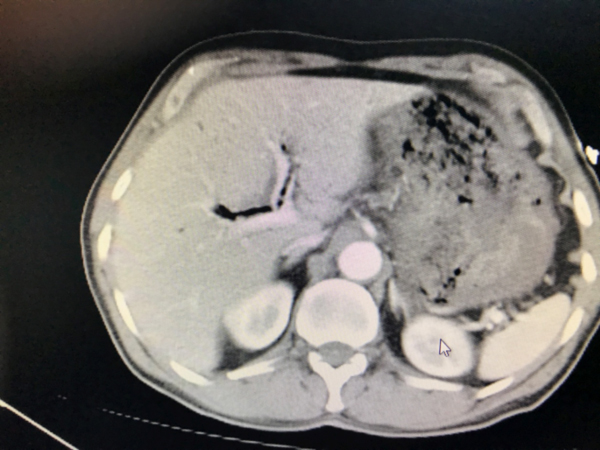 |
|
| Şekil 1: MEKP kazara oral alımı sonrası 1. günde BT görüntüsü | |
Literatürdeki vakalarda da benzer BT bulguları mevcuttur. MEKP maruziyeti sonrası gastrointestinal sistemde organ duvarlarında, safra yollarında amfizematöz yaygın gaz oluşumunun görüldüğü bildirilmiştir.
MEKP maruziyetinde, BT Özellikle GİS’te, KC’de ve safra yollarında amfizematöz gaz oluşumunun değerlendirilmesinde, perforasyon varlığının saptanmasında cerrahi endikasyon için oldukça faydalıdır. Ayrıca özefajit için evrelendirme yapılmasını sağlayacaktır. MEKP içen hastalarda BT görüntülemenin tanısal çalışmalara eklenmesi önerilmektedir. BT ile perforasyonun ekarte edilemediği vakalarda ise, çekilebiliyorsa özefogografi (gastrografin gibi suda eriyen maddeler tercih edilmeli, baryumlu kesin kontrendike) bilgi verici olacaktır.
4. Kostik madde alımlarında Bilgisayarlı Tomografi Evrelemesi nedir?
BT Evrelemesi:
Evre1: Özefagus duvarı normal, ödem yok
Evre 2: Periözefajial dokuda tutulum olmaksızın ödematöz duvar kalınlığı
Evre 3: Periözefajial yumuşak dokulara ödematöz yayılımın vardır, fakat diğer dokulardan ayrımı yapılabilmektedir
Evre 4: Periözefajial yumuşak dokulara infiltrasyonun olduğu, diğer dokulardan ayrımın tam olmadığı, inen aorta ve özefagus çevresinde lokalize sıvı koleksiyonları tespit edilmesi
5. Tedavi nasıl olmalıdır?
Bu hastalarda klasik koroziv madde alımlarında olduğu gibi gastrik dekontaminasyon kontrendikedir. Koroziv madde alımlarında ki geleneksel tedavi metotları uygulanmaktadır. Akut hepatik yetmezlik bulgusu olan hastalara N-Asetil-Sistein, ciddi metabolik asidoz, böbrek yetersizliği gelişen hastalara ise hemodializ önerilmektedir. Literatürde MEKP alımı bildirilen yaklaşık 30 hasta mevcuttur. İncelendiğinde bu hastaların yaklaşık 10’nun(%30) mortalite ile sonuçlandığı görülmektedir. 50-100 ml nin üstü alımlar mortaldir.
Bizim hastamızda alım yaklaşık 10 ml civarında idi. Hastamızda akut dönemde ciddi özefajit saptandı. Tetkiklerinde akut organ yetmezliği kliniği gelişmedi. 3. Gün çekilen kontrol BT’sinde görüntüleme bulguları gerilemişti. Şekil 2’de kontrol BT görülmektedir. Hasta yatışının 8. günü kendi isteğiyle taburcu oldu.
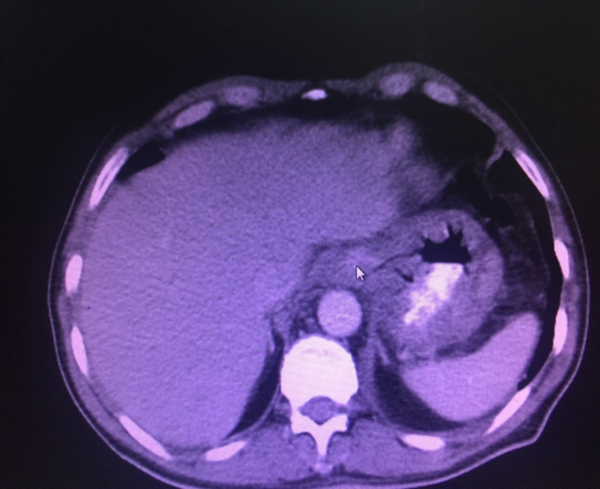
Şekil 2: Yatışının 3. Günü kontrol BT görüntüleme
Hastanın yatışında çoklu organ yetmezliği gelişmemesinin, mevcut tedavinin yanında, alım miktarının az olmasına (yaklaşık 10 ml) bağlandı.
Sonuç olarak metil etil keton peroksit koroziv özefajit kliniğinin yanında çoklu organ yetmezliğine neden olarak ölüme sebebiyet verebilen bir ajandır. Bu hastalarda BT görüntüleme geleneksel yöntemlerden daha fazla bilgi verici olacaktır.
Kaynaklar
- Chang OJ, Choi JW, Hwang Y. A case of severe corrosive esophajitis, gastrits, and liver necrosis caused by ingestion of methyl ethyl ketone peroxide. Cin Exp Emerg Med 2016; 3(4):256-261
- Subbalaxmi MV, Abkari S, Srinivasan VR, Krishnaprasad A. Methyl ethyl ketone peroxide ingestion: A rare cause of corrosive chemical poisoning. Natl Med J India 2010;23:150-1.
- Bates N, Driver CP, Bianchi A. Methyl ethyl ketone peroxide ingestion: toxicity and outcome in a 6-year-old child. Pediatrics 2001;108:473-6.
- Van Enckevort CC, Touw DJ, Vleming LJ. N-acetylcysteine and hemodialysis treatment of a severe case of methyl ethyl ketone peroxide intoxication. Clin Toxicol (Phila) 2008;46:74-8.
Mart
Teknik Editör: Prof. Dr. Mehtap Bulut

Şubat
Teknik Editör: Prof. Dr. Mehtap Bulut

Aralık
Teknik Editör: Prof. Dr. Mehtap Bulut

Ekim
Teknik Editör: Prof. Dr. Mehtap Bulut

Eylül
Teknik Editör: Prof. Dr. Mehtap Bulut

Ağustos
Teknik Editör: Prof. Dr. Mehtap Bulut

Temmuz
Teknik Editör: Prof. Dr. Mehtap Bulut

Haziran
Teknik Editör: Prof. Dr. Mehtap Bulut
Mayıs
Teknik Editör: Prof. Dr. Mehtap Bulut
Nisan
Editör: Doç. Dr. Özlem Köksal
Mart

Dr. Giray Altınok
Şubat

Ocak
Teknik Editör: Prof. Dr. Mehtap Bulut

Aralık
Teknik Editör: Prof. Dr. Mehtap Bulut

Zehirlenmelerde Ekstrakorporeal Tedaviler Yazı Dizisi – VALPROİK ASİT
VALPROİK ASİT (VPA)
Genel :
- Esas olarak parsiyel ve generalize nöbet tedavisi.
- Diğer kullanım alanları : bipolar bozukluk, migren profilaksisi.
- Molekül ağırlığı 144 Da.
- Terapötik dozda plazma pik süresi 1-4 saat (doz aşımında 7 saate kadar çıkabilir)
- Dağılım hacmi 0.1 – 0.5 L/kg
- Terapötik konsantrasyonda (<100 mg/L) proteine %94 oranında bağlanırken, 1000 mg/L üzerindeki konsantrasyonlarda %15’e kadar düşer.
- Metabolizma : birincil olarak glukronik konjugasyon. Daha az oranda mitokondriyal b-oksidasyon ve sitozolik w-oksidasyon. < %3’ü değişmeden idrar ile atılır.
- sitozolik w-oksidasyon sonucu -> 4-en valproat toksik metabolit
- VPA endojen klirensi 5-10 ml/dk ve eliminasyon yarı ömrü terapötik konsantrasyonlarda 12 saat iken, doz aşımında 30 saate kadar çıkabilir.
Klinik :
- Terapötik düzey : 50-100 mg/L (350-700 mmol/L)
- Düzey > 450 mg/L (3125 mmol/L) -> orta veya majör istenmeyen yan etki ve > 48 saat hastane yatış süresi
- Düzey >850 mg/L (5900 mmol/L) -> koma ve metabolik asidoz
- Hafif toksisite dozu : > 200 mg/kg -> ataksi, sedasyon, letarji
- Ciddi toksisite dozu : > 400 mg/kg -> koma, solunum depresyonu, serebral ödem, hemodinamik instabilite, şok.
- Ciddi zehirlenmede laboratuvar : hipernatremi, hipokalsemi, trombositopeni, mitokondriyal fonksiyon bozukluğu (metabolik asidoz, hiperlaktatemi), hiperamonemi (serebral ödem gelişiminden sorumlu tutulur)
Yönetim :
- Havayolunun güvence altına alınması, kardiyovasküler stabilizasyon
- Erken başvuruda tek doz aktif kömür ile gastrointestinal dekontaminasyondan faydalı olabilir.
- MDAC önerilmez.
- Antidot : L-karnitin (kullanımını destekleyen kanıt kısıtlı)

Akut VPA toksisitesi – VPA’in indüklediği hiperamonemik ensefalopati farkı: Klinik hafif VPA toksisitesine benzemekle birlikte, amonyak düzeyi yüksekken, VPA düzeyi normal sınırlarda.
ECTR önerileri: Nöbet ve refrakter hipotansiyon varlığında,
> 1g/kg alımlarda,
hızlı klinik bozulma,
hemodinamik instabilite,
hepatik fonksiyon bozukluğu,
serebral ödem ve
850 mg/L (5450 mmol/L) serum VPA düzeyi.
Literatür tarama :
- Medline, Embase, Cochrane systematic Reviews ve Cochrane Central (12 Temmuz 2012).
- Veritabanlarında valpro* ya ek olarak; diyaliz veya hemodiyaliz veya hemoperfüzyon veya plazmaferez veya plazma değişimi, değişim transfüzyon veya hemofiltrasyon veya hemodiyafiltrasyon veya ekstrakorporeal tedavi veta CRRT tarandı.
- EAPCCT ve NACCT yıllık toplantı tutanakları manuel olarak tarandı (2002-2014).
- Google scholar ve erişilen makalelerin kaynakçaları tarandı.
- Literatür tarama 15 Kasım 2014’te güncellendi.
Sonuç :
79 çalışma dahil edildi : 1 gözlemsel çalışma, 1 toplam sonuçlarla birlikte kontrolsüz kohort, 70 vaka bildirimi veya vaka serisi, 7 farmakokinetik çalışma.
Öneriler :
1- Genel :
Ciddi VPA zehirlenmesinde ECTR önerilir (1D).
Gerekçe : Çalışmalar yetersiz olsa da, ECTR kullanımının VPA’nın eliminasyonunu hızlandıracağı ve kliniği iyileştireceği; ve böylelikle hastanın komada kaldığı süreyi, mekanik ventilasyon ihtiyacını, yoğun bakımda yatış süresini azaltacağı ve serebral ödem gelişmesini önleyeceği gerekçesiyle katılımcılar tarafından risk/fayda dengesi gözetilerek ciddi VPA zehirlenmesinde ECTR önerilmektedir.
2- ECTR endikasyonları :
VPA zehirlenmesinde aşağıdakilerden herhangi biri var ise ECTR önerilmektedir:
Serum VPA düzeyi > 1300 mg/L (9000mmol/L) (1D)
VPA toksisitesiyle ilişkilendirilen serebral ödem (1D) veya şok (1D)
VPA zehirlenmesinde aşağıdakilerden herhangi biri var ise ECTR tavsiye edilir:
Serum VPA düzeyi > 900 mg/L (6250 mmol/L) (2D)
Mekanik ventilasyon gerektiren koma veya solunum depresyonu (2D)
Akut hiperamonemi (2D)
pH < 7.10 (2D)
3- ECTR’nin kesilmesi :
Klinik düzelme belirginleşene kadar (1D) VEYA serum VPA konsantrasyonu 50-100 mg/L (350-700 mmol/L) düzeyine gelene dek (2D) devam ettirilmelidir.
4- ECTR seçimi :
IHD VPA zehirlenmesinde tercih edilen ECTR yöntemidir (1D).
Hemodiyaliz yok ise, hem aralıklı hemoperfüzyon (1D) hem de CRRT (2D) kabul gören alternatiflerdir.
Hemodiyaliz VPA’yı daha hızlı uzaklaştırır, asidozu düzeltir ve amonyağı vücuttan atar.
Hemoperfüzyon daha pahalı, reçine ve kömür kartuş doygunluğuna bağımlı, komplikasyon oranı daha yüksek ve hipokalsemi ve trombositopeni riski mevcut.
Kaynak :
- Ghannoum, M., Laliberté, M., Nolin, T. D., MacTier, R., Lavergne, V., Hoffman, R. S., et al. (2015). Extracorporeal treatment for valproic acid poisoning: Systematic review and recommendations from the EXTRIP workgroup. Clinical Toxicology, 53(5), 454–465. http://doi.org/10.3109/15563650.2015.1035441










