Eylül ayı #TFT yazımız için Fereidooini ve arkadaşlarının “Scorpion envenomation-associated myocarditis: A systematic review” başlıklı güncel derlemesini Türkçeleştirip bizlere sunan Uzm. Dr. Oktay Usluer’e teşekkür ederiz.
Özet
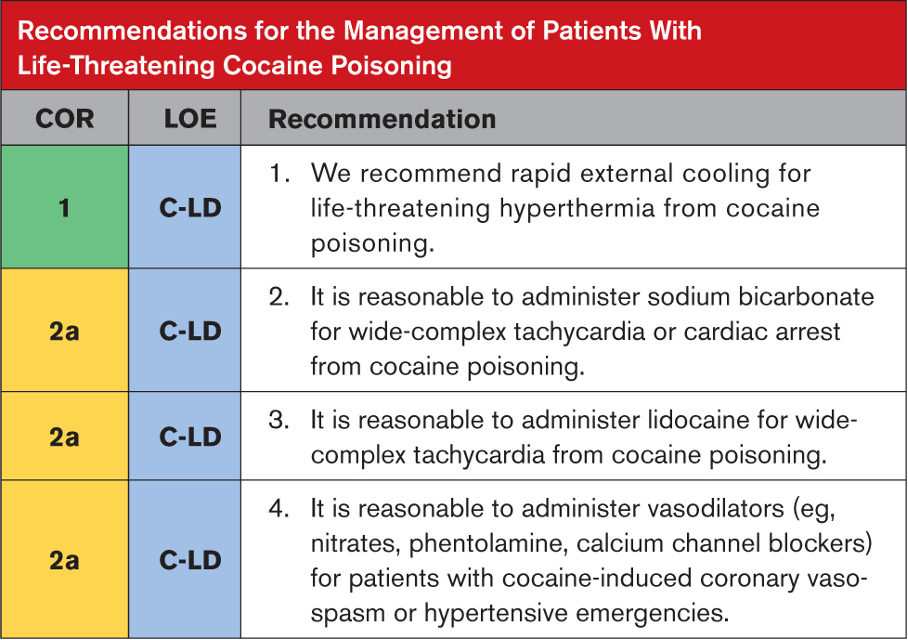
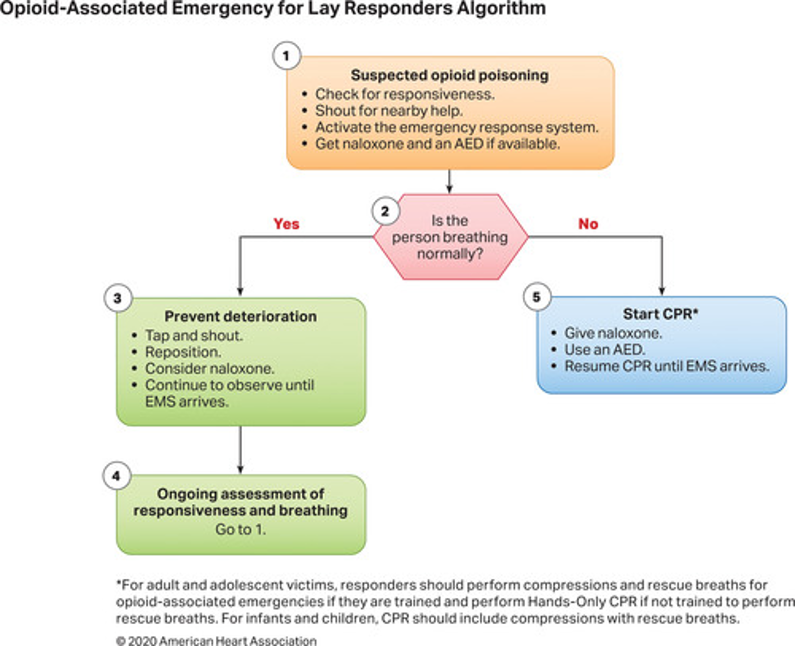
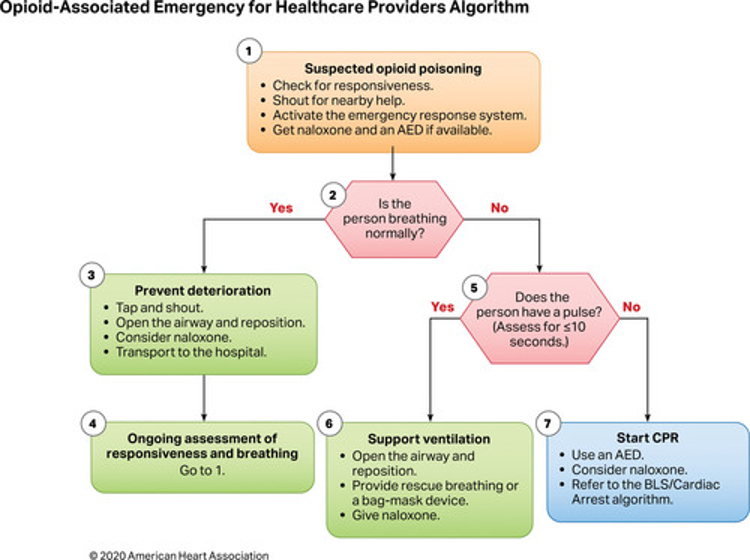
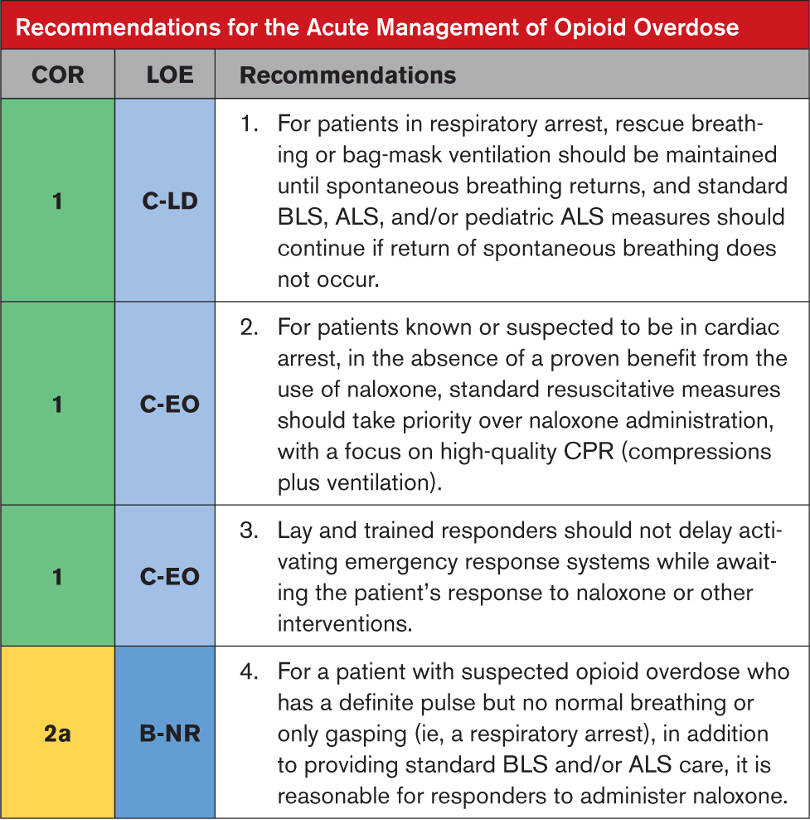
Şiddetli akrep zehri etkisine maruz kalan hastalarla ilgili olarak, doktorlar bölgenin hangi akrep türlerini barındırdığını akılda tutmalıdır, çünkü bu yolla hangi komplikasyonların beklenebileceğini tahmin etmek kolaylaşır. Genel semptomlar akrep sokmasından birkaç dakika sonra ortaya çıkabilirken, kardiyopulmoner semptomların ortaya çıkması birkaç saat sürebilir. Pulmoner ödem ve şok, taşikardi veya hipertansiyondan sonra gelişir, bu nedenle sürekli gözetim önerilir.
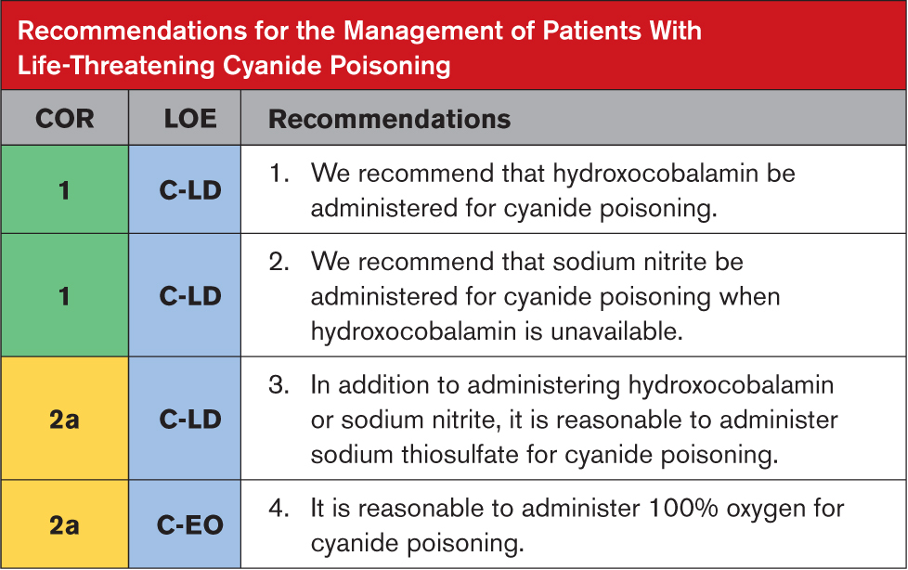
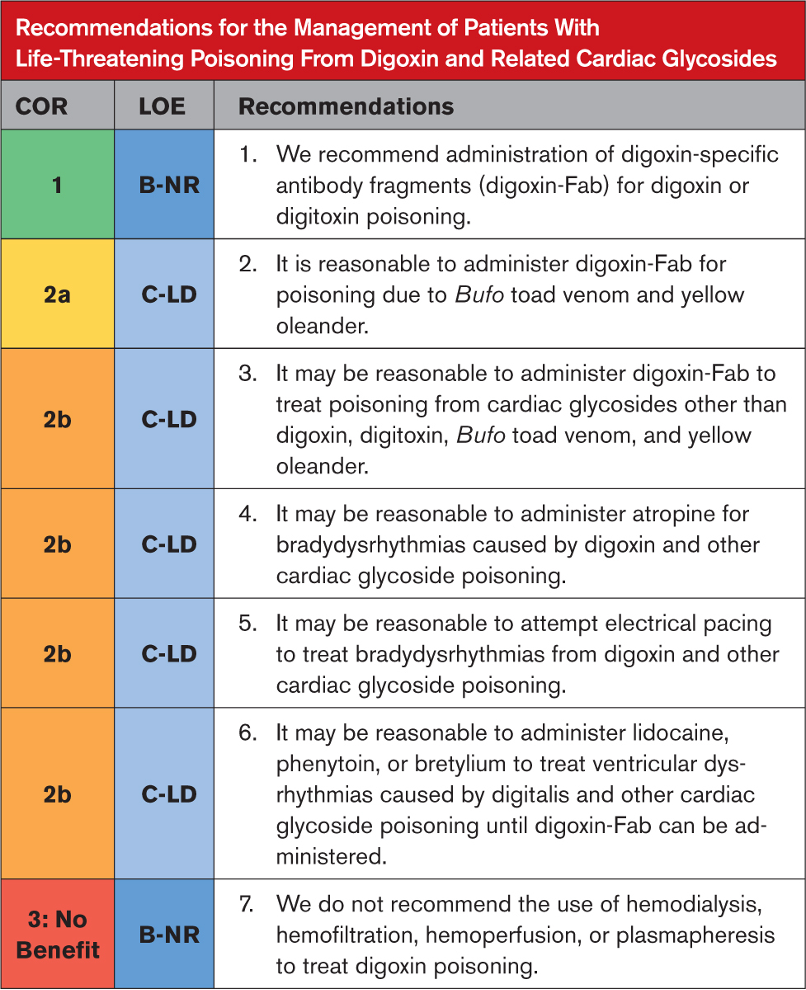
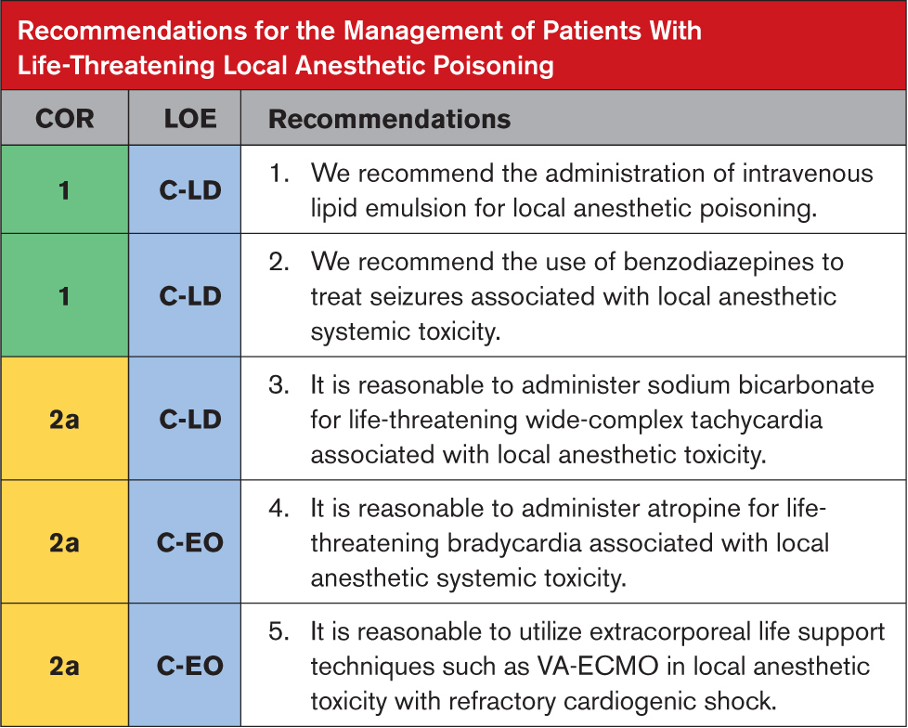
Kardiyak hasar ve pulmoner ödem varlığını değerlendirmek için sistemik zehirlenme bulguları olan hastalarda EKG, seri serum kardiyak biyobelirteçler ve göğüs röntgeni elde edilmesi önerilir. Yüksek kardiyak biyobelirteçler, EKG değişiklikleri ve pulmoner ödem varlığında ekokardiyografi önerilir. Bu tür durumlarda yoğunbakım ünitesi bakımı, rutin laboratuvar incelemeleri ve ağrı yönetimi gibi destekleyici tedaviler başlatılmalıdır. Solunum yetmezliğinde veya yaklaşan solunum yetmezliği durumunda oksijen tedavisi zorunludur. Hipertansiyon ve katekolamin fazlalığı semptomları prazosin ile yönetilebilir. Şok ve hipotansiyon büyük olasılıkla kardiyak kökenlidir, bu nedenle kardiyojenik şok tedavisi kılavuzlarına göre yönetilmelidirler. Ancak norepinefrin ve epinefrin kullanımı önerilmez. Dobutamin en yaygın kullanılan inotropiktir ve pulmoner ödem tedavisinde nitrogliserin, diüretikler ve prazosin kullanılabilir. Şiddetli zehirlenme durumlarında semptomatik ve destekleyici tedavi ile birlikte SAV şiddetle tavsiye edilir. Uygun destekleyici yönetimle, çoğu komplikasyonsuz vakada, klinik iyileşme kısa zamanda başlar ve pulmoner ödem ve şokun regresyonu 48 ila 96 saat içinde gerçekleşir. Ekokardiyogram veya hemodinamik çalışmada LV disfonksiyonunun anlamlı olarak tersine çevrilmesi kabaca bir hafta içinde sağlanır.
Giriş
Akrep zehirlenmesi, özellikle tropikal bölgelerde sık görülen ve farklı kliniklerle ilişkilendirilebilen bir acil durumdur [1]. Son on yılda akrep zehirlenmesinin insidansının ve mortalitesinin arttığı bildirilmiştir [2].
Akrep zehrinin klinik olarak en sık görülen lokal bulgusu genellikle ağrı olup, hafif kızarıklık, kaşıntı, eritem, şişlik yapabilir, nadiren ekimoz, nekroz ve gangrene kadar değişen belirtilere neden olabilir; ayrıca taşikardi, takipne, şok, solunum sıkıntısı yaptığı gibi ajitasyon ve değişmiş zihinsel durum gibi nörolojik bozukluklar da görülebilir. Lokal belirtilerle birlikte bulantı, kusma ve hematüri gibi sistemik belirtiler de ortaya çıkabilir [3,4]. Akrep zehirlenmesinin önemli sistemik tutulumlarından biri de kardiyak prezentasyondur [5]. Pulmoner ödem ve kardiyojenik şok gibi korkutucu komplikasyonlar, genellikle kardiyak tutulum ile ilişkilidir [5,6]. Akrep zehirlenmesine bağlı mortalite, çoğunlukla miyokardit ve akut pulmoner ödemden kaynaklanmaktadır [7].
Klinik, laboratuvar özellikleri ve tanı yöntemleri
Akrep zehirlenmesi birçok komplikasyonla ilişkilidir ve akut miyokardit vakalarının bilinen nedenlerinden biridir [5]. Miyokard hasarı, hemodinamik, metabolik ve miyokard değişkenlerinin karmaşık etkileşimlerinden kaynaklanır; dolayısıyla, zehrin kalp üzerindeki spesifik etkisinin mekanizmasını belirlemek zordur [8]. Akrep zehriyle ilişkilendirilen miyokardite, esas olarak katekolaminlerin ve vazoaktif peptidlerin salınımıyla ilişkilendirilen mekanizmalar neden olur [6]. Akrep zehrinin nörotoksinleri, voltaj kapılı sodyum (Na) ve potasyum (K) kanallarını etkileyerek nöronal uyarılmaya ve sempatik ve parasempatik sinir uçlarından ve adrenal medulladan büyük miktarda asetilkolin, epinefrin ve norepinefrin salınımına yol açar [1,6]. Katekolaminlerin neden olduğu vazokonstriksiyon, afterloadda artışa neden olur [5]. Ayrıca, akrep zehri miyokard iskemisine yol açabilir. Miyokardiyal iskemi, vazokonstriksiyon, artmış miyokard kontraktilitesi ve oksijen talebi gibi etkilerle ilişkilendirilebilir [9,10]. Ayrıca zehrin miyositlerdeki iyon konsantrasyonlarını bozarak miyokard üzerinde doğrudan etkisi olduğu da gösterilmiştir [8,11].
Akrep zehirlenmesine bağlı miyokardit insidansını değerlendirmek zordur. Miyokardit insidansı, akrebin türüne, kullanılan tanı kriterlerine ve hastaların ısırmadan ne kadar süre sonra değerlendirildiğine bağlı olarak değişebilir. Kardiyak biyobelirteçler ve ekokardiyografi bulguları, sokmadan sonra hızla değişebilir ve farklı sonuçlara yönlendirebilir [12]. Abroug ve arkadaşları, akrep zehirlenmesine bağlı akut kalp yetmezliği ve pulmoner ödeme bağlı mortalitenin yaklaşık %0,27 olduğunu bildirmiştir [6]. Literatürde bildirilen vakaların çoğu çocuklardır. Bu, çocukların kardiyojenik şok ve pulmoner ödem gibi kardiyorespiratuar semptomlar geliştirme olasılığının yetişkinlere göre daha yüksek olduğunu bildiren önceki çalışmalarla uyumludur [4]. Tedavi edilmezse, hasta ne kadar gençse ölüm riski o kadar yüksektir [7], bu durum muhtemelen çocuklarda daha yüksek zehir-vücut kütle oranından kaynaklanmaktadır.
Akrep ile ilişkilendirilen kardiyak hasarın histopatolojik olarak gerçek miyokardit olduğu kanıtlanmıştır; patolojik araştırmalarda görülen inflamatuar infiltratlar, nekroz ve doku ödemi, miyokarditin histolojik bulgularıyla uyumludur [13,14]. Ateş, terleme ve huzursuzluk gibi genel belirtiler sempatik uyarım, katekolamin fırtınası ve muhtemelen ağrının sonucu olabilir ve kardiyak tutulumu olan vakalara özgü değildirler [5]. Hiperglisemi, ağır zehirlenmiş bireylerde yaygındır ve diğer elektrolit dengesizliklerine, özellikle hipokalemiye neden olabilir [15]. Bir çalışma, miyokardit belirtisi olmayan vakaların nöbet, koma, karın ağrısı, ileus, oliguri ve düşük tansiyona sahip olma olasılığının daha yüksek olduğunu, miyokardit vakalarının ise pulmoner ödem ve solunum sıkıntısı olma olasılığının daha yüksek olduğunu bulmuştur [16]. Bouaziz ve arkadaşları, pulmoner ödemi olmayan vakalarda da takipne bulunabileceğini bildirmiştir [17].
Katekolamin salınımından kaynaklanan hipertansiyonun erken bir aşaması genellikle vardır; ancak, miyokardiyal sersemleme meydana gelirse, bu hipotansiyon ve şoka dönüşebilir. Hipotansiyon ve bradikardi, özellikle acıdan sonra erken dönemde görülüyor ise, şoktan ziyade parasempatik uyarım nedeniyle olabilir [5,18].
Pulmoner ödemin tüm akrep sokması vakalarının %7-%46’sında mevcut olduğu bildirilmiştir [18]. Başka bir çalışmada 888 akrep sokması vakasının %22,7’sinde pulmoner ödem geliştirdiğini bulunmuştur [19]. Ayrıca, hem insan hem de hayvan modellerinde yapılan hemodinamik çalışmalar, akrep zehri sonrası artmış pulmoner arter basıncı gibi bulguları bildirmiştir [20,21]. Bir çalışma, pulmoner ödemin şiddetinin EF azalması ile korelasyonlu olduğunu bulmuştur [22]. Bu bulgular, pulmoner ödemin hem kardiyak hem de kardiyak olmayan kökenli olduğunu göstermektedir [9,23,24].
Miyokardit vakalarında troponin yüksekliği, miyokardit için tanısal bir gösterge olabilir, ancak her zaman miyokardiyal disfonksiyonu göstermeyebilir [25]. Troponin düzeylerinin seri ölçümü ile birlikte ekokardiyografinin birlikte değerlendirilmesi, kardiyak disfonksiyonu tahmin etmek için önerilmektedir. [26,27,28]. Genel olarak, miyokard disfonksiyonu ve zehirlenmenin şiddeti ile troponin seviyeleri arasında güçlü bir ilişki bulunmaktadır. Bu durum, troponini özellikle etkili bir tarama aracı olarak öne çıkarmaktadır [16,26]. CK-MB’nin çoğu zehirlenme durumlarında (kardiyak disfonksiyonu olmayanlar dahil) yükselme olasılığı yüksek bulunurken, NT-proBNP ve troponin daha spesifik belirteçler olarak kabul edilmektedir [26,27].
Sinüs taşikardisi, en yaygın görülen elektrokardiyogram (EKG) bulgusudur (10,13). Sinüs taşikardisini takiben en sık görülen EKG paternleri ise, miyokarditte kardiyak hasar ve iskeminin göstergesi olabilecek ST-T segment değişiklikleri ve Q dalgalarıdır [29]. Sofer ve arkadaşları kardiyak disfonksiyonu olmayan vakalarda da anormal EKG bulguları bildirmişlerdir [28]. Bu durum, zehrin kendisinin veya sonrasında salınan maddenin veya otonomik uyarının, klinik olarak belirgin miyokardit yokluğunda bile kardiyak elektrik iletimini etkileyebileceğini göstermektedir. İletim bozukluklarının sonucu olarak, yaşamı tehdit eden aritmiler ortaya çıkabilir ve ani ölümlere neden olabilir. Ayrıca, glikoz ve elektrolit dengesizliği gibi faktörler de aritmilere katkıda bulunabilir.
Birkaç çalışma, hemodinamik parametreleri değerlendirmek için pulmoner arter kateterizasyonu kullanmıştır. Bu çalışmaların sonuçları, akut konjestif kalp yetmezliği profiline benzeyen tüm vakalarda kardiyak indekslerin azaldığını, pulmoner arter basıncının ise yükseldiğini göstermiştir. Nouira ve arkadaşları akrep miyokarditinde RV fonksiyonunun da bozulduğunu bulmuşlardır [30].
Akrep sokmasına bağlı miyokarditte ekokardiyografi bulguları, bölgesel veya global hipokineziyi, ventrikül genişlemesini, sol ventrikül ejeksiyon fraksiyonu (LVEF) azalışını, azalmış fraksiyonel kısalma (FS), sağ ventrikül (RV) disfonksiyonunu ve mitral veya triküspit yetersizliğini gösterebilir [31].
Bir vakada kalp yetmezliğinin klinik bulguları varlığında görülen normal ekokardiyografi pulmoner ödemin, akrep zehirlenmesinde ekstra-kardiyak kökenli de olabileceği teorisine işaret etmektedir [24,25]. Das ve arkadaşları çalışmasında miyokarditin klinik kanıtı olmadığında dört hastada ekokardiyografik değişiklikler bulmuş, bu da akrep miyokarditinin bazen subklinik olabileceğini göstermiştir [24]. Sofer ve arkadaşları hastaneye varıştan sonraki 3 saat içinde yapılan ekokardiyografisi normal olan 50 hastadan hiçbirinin, 24 saat sonra tekrarlanan ekokardiyografide anormallik geliştirmediğini göstermiştir. Bu çalışmayı kanıt göstererek ekokardiyografiyi mükemmel bir tanı ve prognostik araç olarak göstermişlerdir [28].
Akrep miyokarditinde kardiyak manyetik rezonans (CMR) ile ilgili bulgular azdır. T1-sekansında artış, sub-epikardial ila intra-miyokardiyal geç gadolinyum geçişi akrep sokmuş hastalarda miyokardit ile uyumlu CMR bulgularıdır [32]. Diğer ilgi çekici bulgu apikal veya bazal baloncuk görülmesidir ki bu bulgu, bazılarının akreple ilişkili miyokarditi “ters Takotsubo sendromu” olarak etiketlemesine yol açmıştır [33].
Perfüzyon sintigrafisi şiddetli akrep zehirinde iskemi varlığını gösterebilir. Dört çalışmada miyokard perfüzyonunu araştırmak için nükleer görüntüleme kullanılmıştır. Duvar hareketi anormallikleri olan 4 vakanın 3’ünde iskemi görülmüştür. Bu çalışmalarda, apikal segmentlerin perfüzyonu daha az etkilenmiş ve interventriküler septum dahil olacak şekilde ventriküler duvarların bazal kısımları daha fazla etkilenmiştir. [9,10].
Tedavi Stratejileri
Akrep Antivenomu (SAV), tetanos toksoidi, analjezi, inotropik ajanlar, digoksin ve prazosin dahil olmak üzere akrep sokmalarında birçok tedavi stratejisi uygulanmıştır. Analjezi tüm sokma vakalarında önerilir, ancak sistemik toksisite kanıtları olan özellikle pediatrik hastalarda opioidlerin kullanılması genellikle önerilmez [34]. Bazı çalışmalarda kortikosteroidler denense de etkinlikleri belirsizliğini korumaktadır [32].
Tüm akrep zehirlenmesi vakalarında SAV’ın rutin uygulaması tartışma konusudur ve ciddi zehirlenme vakalarında faydası daha da belirsizdir. SAV’ın toksine bağlanarak hareket ettiği için, katekolamin salınımı, pulmoner ödem ve şok gibi sistemik etkiler ortaya çıktıktan sonra uygulamasının etkili olmayabileceği öne sürülmektedir [5]. Bazı çalışmalar, dozunun yüksek olması koşuluyla antivenomun etkili olduğunu göstermektedir [34]. Sonuç olarak, SAV lehine birçok çalışma (çoğunlukla gözlemsel) olduğu için SAV’ın faydası gözardı edilmemektedir. Pandi ve ark. tarafından yapılan bir çalışma, SAV ile birlikte prazosin kullanımının iyileşme süresini kısalttığını ve tek başına prazosin kullanımına kıyasla akrep zehirlenmesinde miyokardiyal disfonksiyon insidansını azalttığını göstermiştir [35]. Benzer şekilde, Kumar ve arkadaşları SAV ve prazosinin erken uygulanmasının miyokard disfonksiyonu riskini azalttığını bulmuştur [36].
Akreple ilişkili miyokardit yönetiminin temel dayanak noktası kalp yetmezliği tedavisidir. Solunum ve kardiyopulmoner destek cihazları olan yoğun bakım ünitelerinde kılavuzlar tarafından önerilen inotropların ve diüretiklerin kullanılması önerilmektedir [32]. Kardiyojenik şok kılavuzlarının önemli bir istisnası, akrep zehirlenmesine bağlı miyokarditte norepinefrin ve epinefrin gibi vazopressörlere kıyasla dobutaminin üstünlüğü olabilir, çünkü norepinefrin ve epinefrin, akrep zehiri tarafından indüklenen katekolamin fırtınasında zaten yüksek seviyelerde bulunur. Dobutamin kalbin kasılmasını artırarak hemodinamik parametrelerin iyileşmesini sağlar. Çalışmalar, akrep venomuna bağlı zehirlenmelerde, dobutamin uygulandıktan sonra kardiyak debinin arttığını ve periferik vasküler direncin azaldığını göstermiştir [21]. Pulmoner ödemi tedavi etmek için ön-yükü ve ard-yükü azaltan bir vazodilatör olan nitrogliserin önerilmiştir [5]. Prazosin ayrıca akrep zehrinin kardiyovasküler komplikasyonlarının tedavisinde de kullanılır. Prazosin ön-yükü ve ard-yükü azaltır, merkezi sinir sisteminin sempatik impulslarını azaltır ve insülin salgılanmasını teşvik eder, böylece akrep zehirinin hemodinamik ve metabolik etkilerini antagonize eder [37]. Akrep sokmasının neden olduğu pulmoner ödem tedavisinde de umut vaat etmiştir [38]. Prazosin şu anda akrep zehiri tedavisinde, özellikle hipertansiyon gibi aşırı katekolamin semptomları belirginse önerilmektedir [5,37]. Ancak, şok durumunda kontrendikedir. Zehirlenmenin akut fazı geçene kadar perfüzyonu koruyan ve kardiyak fonksiyonu destekleyen ek seçenekleri de değerlendirmek gerekebilir. Bir çalışmada akrep zehirlenmesi sonrası ilk EF’si %10 olan bir vakada intra-aortik balon pompası kullanılarak refrakter şok düzeltilmiş, hemodinamik optimizasyon ve daha sonra kardiyak fonksiyonun tamamen iyileşmesi sağlanmıştır [39].
İlk kardiyak ve solunum semptomları ortaya çıktıkça non-invaziv veya mekanik ventilasyon şeklinde solunum desteği ve oksijen tedavisi uygulanması son derece önemlidir. Birçok hasta akrep zehirinde solunum yetmezliğinden kaynaklanan hipoksemiden ölmektedir. Mekanik ventilasyon sadece pulmoner ödemin neden olduğu solunum sıkıntısında değil, aynı zamanda bazen şiddetli zehirlenmede ortaya çıkan refrakter şok, şiddetli geçici ensefalopati, hipopne ve apne ataklarında da değerlendirilmelidir [28].
Antihistaminikler, kortikosteroidler ve aspirin çeşitli çalışmalarda incelenmiş ancak anlamlı faydası gösterilememiştir. Nitrogliserin ve sodyum nitroprusid gibi nitratlar, pulmoner ödem olan çeşitli çalışmalarda kullanılmıştır [40].
Akreple ilişkili miyokarditin sonlanımı genellikle iyidir ve mortalite oranı %7,3’tür. Kardiyak fonksiyonun değişimini değerlendirmek için seri ekokardiyografi veya hemodinamik çalışmalar yürüten hemen hemen tüm çalışmalar yaşayan hastalarda EF’de tam iyileşme bildirmiştir (ikincil LVEF>%50) [9,10,22,31]
Bu hastalığın genellikle daha önce sağlık durumu iyi olan çocukları ve genç hastaları etkilediği düşünüldüğünde %7,3’lük mortalite oranı önemlidir. Hayatta kalanlarda LVEF genellikle normale döner, bu da akreple ilişkili miyokarditin muhtemelen klinik olarak belirgin viral miyokarditten daha az komplikasyonla ilişkili olduğunu gösterir. Bawaskar ve arkadaşları kardiyovasküler semptomların şiddetinin hastanın yaşına, vücut kütlesine, mevsimine, enjekte edilen zehir miktarına ve kişinin zehirlenme süresine göre değiştiğini bildirmiştir [41].
Sonuç
Akrep zehirlenmesi ile ilişkili miyokardit, özellikle çocuklarda nadir görülen ancak potansiyel olarak ciddi bir komplikasyondur. Akrep sokmalarının çoğu hafif ila orta derecede semptomlara neden olurken, kardiyopulmoner semptomlar ortaya çıktığında miyokardit ayırıcı tanılar arasında yer almalıdır. Kardiyak belirteçlerin ve ekokardiyografinin kullanımı tanıya yardımcı olabilir.
Tedavinin odak noktası, kardiyojenik şok ve pulmoner ödemin yönetimidir. Doğru ve zamanında yönetimle, olumlu sonuçlar elde edilebilir. Bu nedenle, klinik belirtileri olan hastalarda uygun tarama ve hızlı müdahale önemlidir. Hastaların yakın takibi, semptomların erken tanınmasına ve uygun tedavinin başlatılmasına olanak tanır.
Kaynaklar
- Santos MSV, Silva CGL, Neto BS, Grangeiro Júnior CRP, Lopes VHG, Teixeira Júnior AG, et al. Clinical and Epidemiological Aspects of Scorpionism in the World: A Systematic Review. Wilderness & Environmental Medicine. 2016;27(4):504–18. doi: 10.1016/j.wem.2016.08.003
- Lacerda AB, Lorenz C, De Azevedo TS, Candido DM, Wen FH, Eloy LJ, et al. Scorpion envenomation in the state of Sao Paulo, Brazil: Spatiotemporal analysis of a growing public health concern. PLoS One. 2022;17(4):e0266138.
- Dehghani R, Kamiabi F, Mohammadi M. Scorpionism by Hemiscorpius spp. in Iran: a review. Journal of Venomous Animals and Toxins including Tropical Diseases. 2018;24(1):8. doi: 10.1186/s40409-018-0145-z
- Bahloul M, Chabchoub I, Chaari A, Chtara K, Kallel H, Dammak H, et al. Scorpion envenomation among children: clinical manifestations and outcome (analysis of 685 cases). Am J Trop Med Hyg. 2010;83(5):1084–92. doi: 10.4269/ajtmh.2010.10-0036
- Isbister GK, Bawaskar HS. Scorpion envenomation. N Engl J Med. 2014;371(5):457–63. doi: 10.1056/NEJMra1401108
- Abroug F, Souheil E, Ouanes I, Dachraoui F, Fekih-Hassen M, Ouanes Besbes L. Scorpion-related cardiomyopathy: Clinical characteristics, pathophysiology, and treatment. Clin Toxicol (Phila). 2015;53(6):511–8. doi: 10.3109/15563650.2015.1030676
- Baseer KA, Naser MAA. Predictors for Mortality in Children with Scorpion Envenomation Admitted to Pediatric Intensive Care Unit, Qena Governorate, Egypt. Am J Trop Med Hyg. 2019;101(4):941–5. doi: 10.4269/ajtmh.19-0319
- Yarom R, Braun K. Ca2+ changes in the myocardium following scorpion venom injections. Journal of Molecular and Cellular Cardiology. 1971;2(2):177–9. doi: 10.1016/0022-2828(71)90070-8
- Bahloul M, Ben Hamida C, Chtourou K, Ksibi H, Dammak H, Kallel H, et al. Evidence of myocardial ischaemia in severe scorpion envenomation. Myocardial perfusion scintigraphy study. Intensive Care Med. 2004;30(3):461–7. doi: 10.1007/s00134-003-2082-7
- Figueiredo AB, Cupo P, Pintya AO, Caligaris F, Marin-Neto JA, Hering SE, et al. Assessment of myocardial perfusion and function in victims of scorpion envenomation using gated-SPECT. Arq Bras Cardiol. 2010;94(4):444–51.
- Wang R, Moreau P, Deschamps A, de Champlain J, Sauvé R, Foucart S, et al. Cardiovascular effects of Buthus martensii (Karsch) scorpion venom. Toxicon. 1994;32(2):191–200. doi: 10.1016/0041-0101(94)90108-2
- Gokay SS, Kendir OT, Gulu UU, Nalbant T, Ekinci F, Matyar S, et al. Myocarditis and Early Markers of Cardiac Response Associated with Scorpion Stings in Children. Wildern Environ Med. 2018;29(4):471–8. doi: 10.1016/j.wem.2018.06.013
- Amaral CFS, de Rezende NA, Freire-Maia L. Acute pulmonary edema after Tityus serrulatus scorpion sting in children. The American Journal of Cardiology. 1993;71(2):242–5. doi: 10.1016/0002-9149(93)90746-y
- Cupo P, Jurca M, Azeedo-Marques MM, Oliveira JS, Hering SE. Severe scorpion envenomation in Brazil. Clinical, laboratory and anatomopathological aspects. Rev Inst Med Trop Sao Paulo. 1994;36(1):67–76. doi: 10.1590/s0036-46651994000100011
- Miranda CH, Maio KT, Moreira HT, Moraes M, Custodio VIdC, Pazin-Filho A, et al. Sustained Ventricular Tachycardia and Cardiogenic Shock due to Scorpion Envenomation. Case Reports in Medicine. 2014;2014:251870. doi: 10.1155/2014/251870
- Abdel Baseer KA, Aboelela MG, Qubaisy HM. Echocardiographic Evaluation of the Response to Prazosin Treatment in Scorpion Sting. J Trop Pediatr. 2021;67(3). doi: 10.1093/tropej/fmaa063
- Bouaziz M, Bahloul M, Hergafi L, Kallel H, Chaari L, Ben Hamida C, et al. Factors Associated with Pulmonary Edema in Severe Scorpion Sting Patients–A Multivariate Analysis of 428 Cases. Clin Toxicol. 2006;44(3):293–300. doi: 10.1080/15563650600584501
- Gueron M, Ilia R, Margulia G. Arthropod poisons and the cardiovascular system. The American Journal of Emergency Medicine. 2000;18(6):708–14. doi: 10.1053/ajem.2000.9265
- Bawaskar HS, Bawaskar PH. Envenoming by scorpions and snakes (Elapidae), their neurotoxins and therapeutics. Trop Doct. 2000;30(1):23–5. doi: 10.1177/004947550003000112
- Abroug F, Ayari M, Nouira S, Gamra H, Boujdaria R, Elatrous S, et al. Assessment of left ventricular function in severe scorpion envenomation: combined hemodynamic and echo-Doppler study. Intensive Care Med. 1995;21(8):629–35. doi: 10.1007/BF01711539
- Elatrous S, Nouira S, Besbes-Ouanes L, Boussarsar M, Boukef R, Marghli S, et al. Dobutamine in severe scorpion envenomation: effects on standard hemodynamics, right ventricular performance, and tissue oxygenation. Chest. 1999;116(3):748–53. doi: 10.1378/chest.116.3.748
- Mazzei de Dàvila CA, Dàvila DF, Donis JH, de Bellabarba GA, Villarreal V, Barboza JS. Sympathetic nervous system activation, antivenin administration and cardiovascular manifestations of scorpion envenomation. Toxicon. 2002;40(9):1339–46. doi: 10.1016/s0041-0101(02)00145-9
- Celik E, Caglar A, Celik SF. Clinical Effects and Predictive Factors Affecting the Clinical Severity of Scorpion Envenomations in Western Turkey. J Trop Pediatr. 2021;67(3):11. doi: 10.1093/tropej/fmab053
- Gueron M, Ilia R. Non-cardiogenic pulmonary oedema after scorpion envenomation: a true entity?Toxicon. 1996;34(4):393–5. doi: 10.1016/0041-0101(95)00147-6
- Chakroun-Walha O, Karray R, Jerbi M, Ben Rebeh A, Jammeli C, Bahloul M, et al. Value of troponin levels in the diagnosis of cardiac dysfunction in moderate scorpion envenomation. Hum Exp Toxicol. 2018;37(6):580–6. doi: 10.1177/0960327117722822
- Meki A, Mohamed ZMM, El-Deen HMM. Significance of assessment of serum cardiac troponin I and interleukin-8 in scorpion envenomed children. Toxicon. 2003;41(2):129–37. doi: 10.1016/s0041-0101(02)00155-1
- Prakash VJ, Patil MM, Sajjan AK, Patil SV, Kalyanshettar SS, Shannawaz M. Acute myocarditis in children with scorpion sting envenomation. Curr Paediatr Res. 2021;25(4):578–82
- Sofer S, Zucker N, Bilenko N, Levitas A, Zalzstein E, Amichay D, et al. The importance of early bedside echocardiography in children with scorpion envenomation. Toxicon. 2013;68:1–8. doi: 10.1016/j.toxicon.2013.02.016
- Mohammadi H, Fereidooni R, Mehdizadegan N, Amoozgar H, Naghshzan A, Edraki MR, et al. Q wave in paediatric myocarditis: an underinvestigated, readily available prognostic factor. Acta Cardiologica. 2022:1–10. doi: 10.1080/00015385.2022.2148896
- Nouira S, Abroug F, Haguiga H, Jaafoura M, Boujdaria R, Bouchoucha S. Right ventricular dysfunction following severe scorpion envenomation. Chest. 1995;108(3):682–7. doi: 10.1378/chest.108.3.682
- Cupo P, Hering SE. Cardiac troponin I release after severe scorpion envenoming by Tityus serrulatus. Toxicon. 2002;40(6):823–30. doi: 10.1016/s0041-0101(02)00080-6
- Caforio AL, Pankuweit S, Arbustini E, Basso C, Gimeno-Blanes J, Felix SB, et al. Current state of knowledge on aetiology, diagnosis, management, and therapy of myocarditis: a position statement of the European Society of Cardiology Working Group on Myocardial and Pericardial Diseases. Eur Heart J. 2013;34(33):2636–48, 48a-48d.
- Abroug F, Ouanes I, Maatouk M, Golli M, Ouanes-Besbes L. Inverted Takotsubo syndrome in Androctonus australis scorpion envenomation. Clin Toxicol. 2018;56(5):381–3. doi: 10.1080/15563650.2017.1377221
- Chippaux JP. Emerging options for the management of scorpion stings. Drug Des Devel Ther. 2012;6:165–73. doi: 10.2147/DDDT.S24754
- Pandi K, Krishnamurthy S, Srinivasaraghavan R, Mahadevan S. Efficacy of scorpion antivenom plus prazosin versus prazosin alone for Mesobuthus tamulus scorpion sting envenomation in children: a randomised controlled trial. Arch Dis Child. 2014;99(6):575–80. doi: 10.1136/archdischild-2013-305483
- Kumar PM, Krishnamurthy S, Srinivasaraghavan R, Mahadevan S, Harichandrakumar KT. Predictors of Myocardial Dysfunction in Children with Indian Red Scorpion (Mesobuthus tamulus) Sting Envenomation. Indian Pediatr. 2015;52(4):297–301. doi: 10.1007/s13312-015-0627-9
- Gupta BD, Parakh M, Purohit A. Management of Scorpion Sting: Prazosin or Dobutamine. J Trop Pediatr. 2009;56(2):115–8. doi: 10.1093/tropej/fmp070
- Gupta V. Prazosin: A Pharmacological Antidote for Scorpion Envenomation. J Trop Pediatr. 2006;52(2):150–1. doi: 10.1093/tropej/fmi097
- D’sa SR, Peter JV, Chacko B, Pichamuthu K, Sathyendra S. Intra-aortic balloon pump (IABP) rescue therapy for refractory cardiogenic shock due to scorpion sting envenomation. Clin Toxicol. 2016;54(2):155–7. doi: 10.3109/15563650.2015.1116043
- Ersoy S, Yilmaz F, Sonmez BM, Kara AY, Guclu A. A Case of Acute Myocarditis and Rhabdomyolysis after a Scorpion Sting. J Emerg Med Case Rep. 2017;8(1):10–2.
- Bawaskar HS, Bawaskar PH. Cardiovascular manifestations of severe scorpion sting in India (review of 34 children). Annals of Tropical Paediatrics. 1991;11(4):381–7. doi: 10.1080/02724936.1991.11747534