Resim 1: Amanita Mantar Ailesi
Mantar alımlarında en sık gastrointestinal(GI) toksisite görülür. Birçok mantar türü GI toksisiteye sebep olabilmektedir. İlk yaklaşım gastrik lavaj yolu ile dekontaminasyon ve aktif kömür ile emilimi azaltmak olmalıdır.
Nörotoksisite ile alakalı genel olarak kötüye kullanım amacıyla alım söz konusudur. Hastalara gelişen semptomlara göre tedavi verilmelidir. Gereklilik halinde diazepam ile sedasyon verilebilir. Semptomları kendi kendilerini sınırlar ve 3-4 saat içerisinde geçer.
Bizim acil servislerde endişe duyduğumuz kısmı ise gecikmiş toksisiteye neden olan mantarlardır. Bunlarında en meşhuru kültür mantarıyla sıklıkla karışan, amatoksin içeren “amanita phalloides” “köygöçürten”(namını oldukça hakediyor)dir. Diğer bir mantar türü de “gyromitra esculenta”dır. Bu mantar “kuzu göbeği mantarı” olarak bilinen ve yenilebilir bir mantar türü olan “morchella conica” ile karıştırılmaktadır. Bu mantarda da nörolojik semptomlara sebep olabilen hatta nöbete dahi neden olabilen “giromitrin” toksini bulunmaktadır. Alımdan 6 saat sonra başlayan şiddetli GI semptomları ile kendilerini gösterirler. Amatoksine bağlı zehirlenmelerde hipovolemi ve hipoglisemi gelişebilir. GI semptomlar 12 saat içerisinde düzelme gösterir. Giromitrinde ise baş ağrısı baş dönmesi gibi nörolojik semptomlarda eşlik eder.

Resim 2 : Birbirine karıştırılıp tüketilen Gyromitra esculanta (toksik) ve Morchella Conica
Hastalar genellikle GI semptomlarının başlangıcından sonra hastaneye başvururlar. Eğer alımdan sonra ilk bir iki saatlik dönemde başvururlarsa GI dekontaminasyon uygulanmalıdır. Özellikle amatoksinde tekrarlayan doz aktif kömür (4-6 saatte bir 24 saat süreyle) uygulanması önemlidir. Bunların haricinde hastaları 48 saat yakın monitorizasyon ve karaciğer yetmezliği açısından yakın takip etmek gerekmektedir.
Amatoksinin atılımı idrar yolu ile gerçekleşmektedir. Bu nedenle zorlu diürez atılımı artırmak için denenebilir. Ayrıca karaciğere toksin alınımını bloke eden ve böbrekten atılımını arttırdığı için Penisilin G (300000-1000000ünite/kg/gün) kullanılır. Karbon filtreyle hemodiyaliz veya hemoperfüzyonda yine toksini uzaklaştırmak için kullandığımız tedavi yöntemlerindendir. Ancak bütün bu tedavilere rağmen karaciğer yetmezliğine giden hastalar olmaktadır. İlerleyici koagülopatisi olan ve ensefalopati gelişen hastalarda acil karaciğer nakli gerekmektedir. Fulminan karaciğer yetmezliği durumunda transplantasyon tek şanstır.

Son günlerde bazı toksikasyonlarda kullanılabilen “teröpatik plazma exchange (TPE”) tedavisinin mantarda kullanımı ile ilgili vaka sunumları yayınlanmaya başladı. Her ne kadar amatoksin albümine bağlanmasa ve bu durum TPE’nin temel mantığına aykırı olsa da oluşan zararlı endojen bileşiklerin uzaklaştırılmasında yararlı olabileceği düşünülmektedir. Bu konuyla alakalı henüz yeterli çalışma bulunmamakla birlikte. Karaciğer nakline kadar olan sürede denenebilir bir yöntem gibi gözükmektedir.
Bazı mantarlarda nefrotoksik özellikler içermektedir. “Continarius Orellanus” türü bu mantar alımından sonra parestezi, tat alma duyusunda bozulma ve kognitif değişiklikler gelişebilir. Buna “Orellanus Sendromu” ismi verilmektedir. Üçüncü günden sonra böbrek fonksiyonlarında bozulma gelişen hastaların %50’sinde fonksiyonlar kendiliğinden geri dönmektedir. Geriye kalan hastalarda ise hemodiyaliz ihtiyacı gelişmektedir.
Bizim vaklarımızda da mantarın türünü tam olarak tespit edilemediği için en olası şüpheli olan amanita phelloides’e yönelik hemodiyaliz penisilin G ve diürez tedavisi yapıldı. Sonradan gelişen ajitasyon ve halüsinasyonlarına yönelik tedavileri verildi. Hastalarımız herhangi bir komplikasyon gelişmeden taburcu oldular.
Sonuç olarak mantarlar için standart bir tedavi protokolü yoktur. En etkin tedavi yolu ise maruziyeti tamamen ortadan kaldırabilmektir. Mantarın türünün iyi sorgulanması (görsellerle desteklemek faydalı olabilir) önem arz etmektedir. İntoksikasyonların çoğu amanites ailesine bağlı olarak (%90-95) gelişmekte olduğundan rutin tedavi buna yönelik verilmektedir. Ancak diğer toksik mantar türleri de akılda tutularak bunların sorgulaması da iyi bir şekilde yapıldıktan sonra tedavi yaklaşımı belirlenmelidir. Erken başlangıçlı semtpomları olan hastalarda tablo genellikle birkaç saat içerisinde düzelir. Ek bir semptom yoksa hasta taburcu edilir. Nörolojik bulguları olan hastalarda 6-8 saat sonra düzelme görülür ve bu hastalarda tam düzelme olduktan sonra taburcu edilebilir. Ancak semptomları geç başlayan hastalarda tablo 2-3. günden sonra ortaya çıkacağı için bu hastaları hastaneye yatırarak yakın takibe almak gerekir.
Kaynaklar:
- Oztekin-Mat A. Mushroom Poisoning in Turkey Ann Pharm Fr 1998;56(5):233-5.
- Chen, Zuohong, Ping Zhang, and Zhiguang Zhang. “Investigation and analysis of 102 mushroom poisoning cases in Southern China from 1994 to 2012.” Fungal Diversity 64.1 (2014): 123-131.
- Cheung, Samuel Tsz‐chun, et al. “Food Poisoning Case Studies: Mushroom and Pufferfish Toxin Investigation.” Analysis of Food Toxins and Toxicants, 2 Volume Set (2017): 217.
- Chen, Li, et al. “Therapeutic plasma exchange in treating multi-organ injury at the later stage of mushroom poisoning: Three case reports.” (2017): 61-64.
- Chan, C. K., et al. “Mushroom poisoning in Hong Kong: a ten-year.” Hong Kong Med J 22.2 (2016): 124-30.
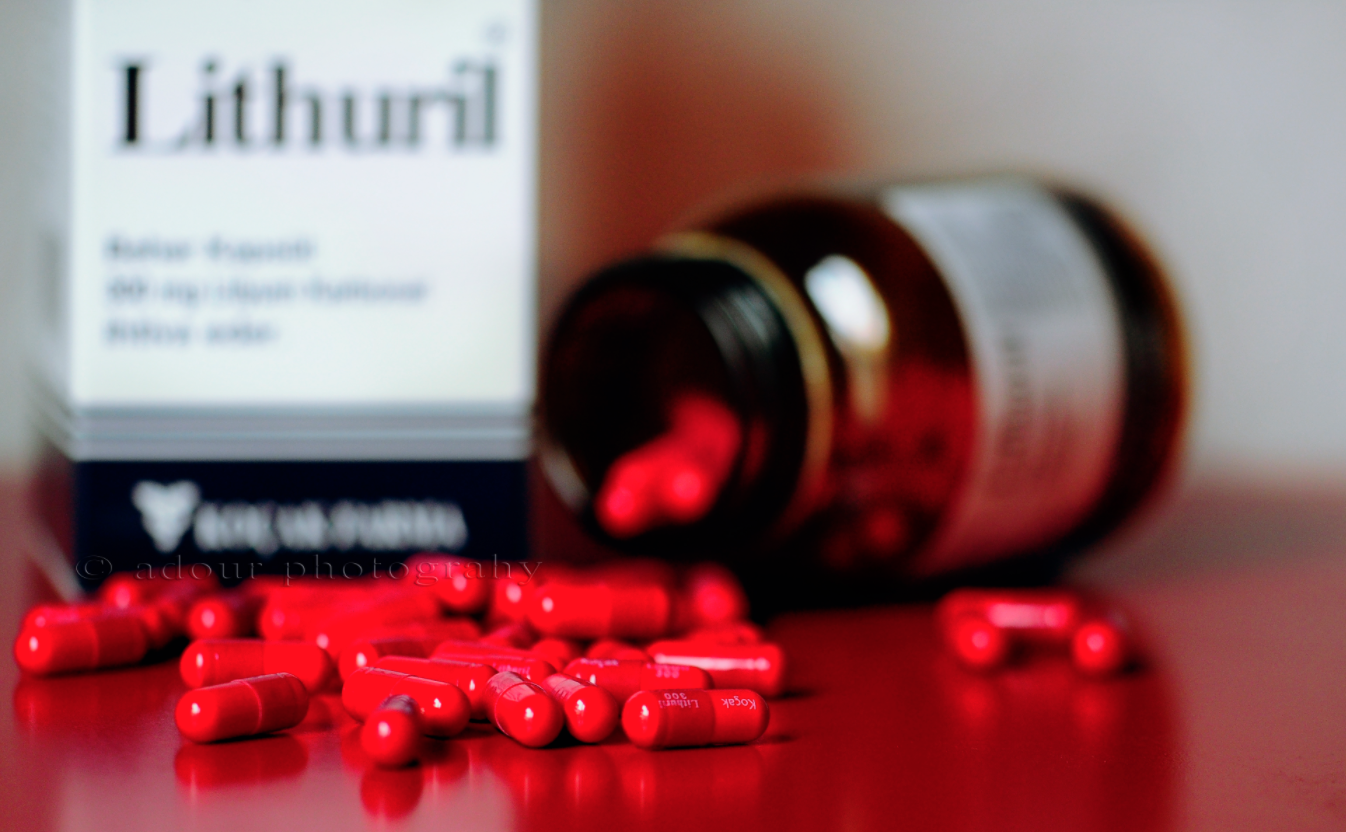
Acil servislerde her an karşılaşabileceğimiz ‘Lityum Zehirlenmesi’ ni, yukarıdaki vaka üzerinden 5 soru ile tartışmayı hedefliyorum.
LİTYUM İNTOKSİKASYONU
1-Lityum’un Etki Mekanizması ve Toksikokinetiği Nasıldır?
Lityum küçük monokovalan bir katyondur. Primer olarak; lityum karbonat formu ile bipolar affektif bozukluk tedavisinde kullanılır. Etki mekanizması tam olarak anlaşılmamış olsa da, inozitol trifosfat gibi ikincil iletkenler üzerinden etki ettiği ve nörotransmitter üretimi ve salınımını düzenlediği düşünülmektedir.
Lityum karbonat’ın normal salınımlı formları (250 mg) ve uzamış salınımlı formları (450 mg) bulunmaktadır.
ADME
- Emilim (Absorption): Normal salınımlı formlarında emilim 6-8 içerisinde tamamlanır. Pik plazma değerlerine ilk 4 saat içerisinde ulaşır, yavaş salınımlı formlarında ise bu süre 12 saate kadar uzayabilmektedir.
- Dağılım (Distribution): Dağılım hacmi (Vd): 0.7-0.9 L/g’dır. Doku kompartmanlarına yavaş giriş yapar (örn: SSS). Plazma proteinlerine bağlanmaz.
- Metabolizma (Metabolism): Metabolize olmaz.
- Atılım (Excretion): Tama yakını renal yolla atılır. Az miktarda kemik sekestrasyonu mevcuttur. Atılımı kreatinin klirensine bağlıdır. Bu sebeple hipovolemi, hiponatremi ve renal yetmezlik gibi durumlarda atılımı azalır. Atılım yarılanma ömrü 24 saattir.
2-Plazma Lityum Düzeyi Görülmeli midir? Neden?
Normal plazma değerleri; 0.6-1.4 mmol/L ‘dir ve ‘EVET’ mümkünse görülmelidir.
Lityum toksitesi 2 şekilde prezente olabilir.
- Akut Toksikasyon: Neredeyse tamamen bilinçli akut yüksek doz alımlardır (suisid). Akut alımlarda, lityum plazma düzeyi görmek; toksiteyi konfirme etmek açısından işe yarar. Aralıklı lityum düzeyi görmek ise lityum atılımı süreci ve tedavinin etkinliği açısından fikir verici olacağı gibi taburculuk kararı vermede de yönlendirici olacaktır. Akut alımlarda lityum düzeyi zehirlenmenin düzeyi ile ilişkilidir.
- Kronik Toksikasyon: Sıklıkla tedavi amacı ile lityum kullanan hastalarda atılımın yavaşlaması (renal yetm., hipovolemi vs) ile oluşmaktadır. Lityum düzeyi kronik zehirlenmelerde tanıyı konfirme etmek açısından yaralıdır ancak plazma lityum düzeyinin yüksekliği zehirlenmenin şiddeti ile ilişkili değildir çünkü kronik alımlarda lityum düzeyi doku kompartmanlarına ne kadar giriş olduğunu net göstermez (özellikle SSS). Akut toksikasyonlarda olduğu gibi kronik toksikasyonlarda da düzey monitorizasyonu tedavi sürecinin yönetmede yararlı olacaktır.

3-Akut Lityum Toksitesinin Klinik Bulguları Nelerdir?
Akut lityum zehirlenmesi sıklıkla, lityumun gastrointestinal sistem üzerindeki irritan etkilerine sekonder gelişen semptomlarla karşımıza çıkar.
Semptomlar:
- Bulantı
- Kusma
- Karın ağrısı
- İshal
4- Lityum toksikasyonlarında Risk Değerlendirmesi Nasıl Yapılmalıdır?
Alınan miktar semptom şiddeti ile ilişkilidir;
- <25 gr alımlar: Sıklıkla beningdir. Yukarıda bahsi geçen semptomlar olmayabilir veya hafif şekilde görülebilir.
- >25 gr alımlar: Ciddi GİS semptomları ile prezente olur. Yüksek doz alımlarda ve özellikle atılımın azaldığı durumlar da eşlik ediyorsa SSS etkilenmesi ile nörotoksite gelişebilir.
Bu hastada yüksek doz akut lityum alımı mevcut (>25 gr) ve hasta GİS semptomları ile karşımıza çıktı. Buna ek olarak hastanın hafif renal yetmezliği olduğunu da akılda tutmak gerekli ki eğer renal yetmezliği daha da artacak olursa nörotoksite gelişme olasılığı da artacaktır.
İshal ve kusma gibi semptomların artışı veya uzun süredir olması hipovolemiye sebep olacaktır. Bu durum, lityum atılımının azalmasına sebep olur ve buna sekonder olarak zehirlenmenin şiddetini arttır, nörotoksite görülebilir.
5-Akut Lityum Toksitesi Nasıl Yönetilmelidir?
Lityum atılımı renal fonksiyon ile ilişkili olduğundan destek tedavisi hem akut hem de kronik zehirlenmelerde tedavinin en önemli komponentidir.
- Resüsitasyon
Hastalar, resüsitasyon malzemelerinin ve resüsitatörlerin olduğu tam donanımlı bir ortamda değerlendirilmelidir.
- Destek Tedavisi ve Monitorizasyon
Renal yetmezliği engellemek için, sıvı açığının hesaplanması ve kontinü IV sıvı
- FAST HUGS BID
Tüm kritik hastaların takibinde uygulanması önerilen FAST HUGS BID (tıklayınız) yaklaşımının Lityum zehirlenmesi olgularında da hatırlanması önemlidir.

- Gerekli Tetkikler ve Düzeyler
Üre, elektrolitler, kreatin istenmelidir. 12 derivasyon EKG görülmelidir. Lityum zehirlenmesi düşünülen hastanın hem ilk gelişinde hem de tedavi ve takip süresi boyunca lityum düzeyi görülmelidir. Bunun yanı sıra, çoklu ilaç alımı şüphesi olan hastalarda parasetamol düzeyi de görülmelidir.
- Dekontaminasyon
Tüm barsak irrigasyonu yükek dozda alınmış, uzamış salınımlı zehirlenmelerde önerilmektedir. Ancak literatürde Lityum zehirlenmelerinde, tüm barsak irrigasyonunun tek başına destek tedavisinden daha üstün olduğuna dair bir kanıt bulunmamaktadır. Aktif kömür önerilmemektedir.
- Antidot
Akut veya kronik Lityum toksitesinde kullanılacak bilinen bir antidot yoktur.
- İleri Eliminasyon
Lityum, proteine bağlanmadığından ve düşük dağılım hacmi olasından dolayı hemodiyalize (HD) uygun bir ajandır. Akut toksitede böbrek yetmezliği olan ve nörotoksite gelişmiş olan hastalarda HD önerilmektedir. Akut toksitede HD için önerilen bir Lityum düzeyi bulunmamaktadır. Bunun aksine kronik toksitede >2.5mmol/L ‘de HD önerilmektedir.
- Taburculuk
Renal yetmezliği ve/veya nörotoksitesi olan hastalar yoğun bakımda takip edilmelidir. Renal fonksiyonları normale dönen ve nörotoksite bulguları kalmayan hastalar yoğun bakım takibinden çıkarılabilirler. Renal yetmezliği ve nörotoksitesi olmayan hastalar, GIS semptomları sonlandığında ve lityum düzeyleri normale döndüğünde taburcu edilebilirler.
KAYNAKLAR
- Katzung B, Masters S and Trevor, A. Basic and Clinical Pharmacology (11th Edition), McGraw-Hill, San Francisco, 2009
- Murray L, Daly FFS, Little M and Cadogan M. Toxicology Handbook (2nd Edition), Elsevier Australia 2011
- Waring WS. Management of lithium toxicity. Toxicology Reviews 2006; 25(4):221-230. PMID: 17288494
- MIMS Online (database) accessed 25/2/2011
TEOFİLİN
Genel :
- Bitkisel kaynaklı metilksantin bileşiğidir. Kafein, paraksantin ve teobromine benzer.
- Kullanım : Astım nedenli bronkospazm, kronik obstruktif akciğer hastalığı (KOAH), neonatal apne, letarji ve kilo kaybı.
- Selektif b2 agonistler çıktıktan sonra daha az tercih edilir olmuşlardır.
- 180 Da’lık küçük bir molekül. %40-60 proteine bağlanır (siroz ve üremide, bebeklerde daha az).
- Oral biyoyararlanım : %90 -> terapötik dozda 1-2 saatte serum pik düzeyi
- Dağılım hacmi : 0.5 L/kg
- Metabolizma : sitP450 sistemi ile. %10’u böbrekten değişmeden atılır.
- Sigara içmeyenlerde yarı ömür : 8-11 saat;
- Vücuttan klirens hızı 40-60 ml/dk. Doz aşımında yavaşlar.
- Terapötik düzey aralığı : 5-15 mg/L (28-83mmol/L)
- Terapötik etki : endojen katekolaminlerin salınımını arttırır ve adenozin etkilerini antagonize eder. -> b1 ve b2 adrenerjik stimulasyon ve histamin salınımının kontrolü.
- Toksik doz : fosfodiesteraz inhibisyonu -> cAMP parçalanmasını engeller.
Klinik :
- Akut doz aşımı erken semptomlar : anoreksi, bulantı, kusma
- Konsantrasyon arttıkça => inatçı kusma
- Kardiyovasküler etkiler : hipotansiyon, sinüs taşikardisi, atriyal ve ventriküler distritmiler.
- SSS etkileri : baş ağrısı, anksiyete, tremor, irritabilite, ajitasyon ve konsantrasyon daha da artarsa nöbet.
- Kronik toksisitede kardiyovasküler ve nörolojik semptomlar GİS semptomlarından daha baskın.
- b adrenerjik reseptör ilişkili hücreiçi şifte bağlı – hipokalemi.
- Laktat birikimi sonucu – metabolik asidoz
- Hiperglisemi, lökositoz.
- Serum teofilin düzeyi ile klinik korele olmayabilir.
Yönetim :
- Antidot yok – genel destek tedavisi.
- Kardiyak ileti bozuklukları için – potasyum gerekebilir (Rebound etkiye dikkat!)
- Dekontaminasyon – MDAC – teofilin > 50 mg/L (278 mmol/L) ise inatçı kusma MDAC için engel oluşturur.
ECTR farklı öneriler
Öneri : Semptomdan bağımsız olarak > 80-100 mg/L (444–555 mmol/l),
Öneri : Semptomdan bağımsız olarak > 150 mg/L (833 mmol/l) ,
Öneri : Kronik doz aşımında > 40-60 mg/L (222–333 mmol/l)
Öneri : Teofilin düzeyi veya maruziyetin kronik olup olmamasına bakılmaksızın => Disritmi, nöbet, bilinçte bozulma, hipotansiyon
Öneri : Teofilin düzeyi + semptoma (nöbet, devam eden hipotansiyon, disritmi) göre / MDAC verilememesi / komorbidite varlığı / yaş
Literatür tarama :
- Medline, Embase, Cochrane systematic Reviews ve Cochrane Central (12 Temmuz 2012).
- Veritabanlarında teofilin veya aminofilin veya kafein veya metilksantine ek olarak; diyaliz veya hemodiyaliz veya hemoperfüzyon veya plazmaferez veya plazma değişimi, değişim transfüzyon veya hemofiltrasyon veya hemodiyafiltrasyon veya ekstrakorporeal tedavi veta CRRT tarandı.
- EAPCCT ve NACCT yıllık toplantı tutanakları manuel olarak tarandı (2002-2014).
- Google scholar ve erişilen makalelerin kaynakçaları tarandı.
- Literatür tarama 15 Kasım 2014’te güncellendi.
SONUÇ :
141 makale dahil edildi : 4 gözlemsel çalışma, 7 betimsel kohort, 101 vaka bildirimi/vaka serisi, 19 SDBY hastasında farmakokinetik çalışma, 1 klinik karşılaştırmalı hayvan çalışması, 3 hayvan toksikokinetik çalışma ve 6 invitro çalışma.
Öneriler :
1-Genel : Ciddi teofilin zehirlenmesinde ECTR önerilir (1C).
Gerekçe : Teofilin bir hayli diyalizabl bir madde. Toksisitesine nöbet, disritmi hipotansiyon, rabdomiyoliz gibi hayatı tehdit edici yan etki gelişme riski vardır. Yüksek konsantrasyonlarda eliminasyonu da gecikerek toksisite süresini uzatır. ECTR hızlıca metilksantinleri hem SSS’den hem de tüm vücuttan hızlıca uzaklaştırır. Asidemi, hipokalemi ve hipertermiyi düzeltmeye yardımcı olur.
2-ECTR Endikasyonları :
Aşağıdaki durumlarda ECTR önerilir:
- Akut maruziyettte teofilin düzeyi > 100 mg/L (555 mmol/l) ise (1C)
- Nöbet var ise (1D)
- Hayatı tehdit edici disritmi var ise (1D)
- Şok var ise (1D)
- Uygun tedaviye rağmen serum teofilin düzeyi artıyor ise (1D)
- Uygun tedaviye rağmen klinik bozulma var ise (1D)
Aşağıdaki durumlarda ECTR tavsiye edilir:
- Kronik maruziyette teofilin düzeyi > 60 mg/L (333 mmol/l) ise (2D)
- Kronik maruziyette hasta < 6 ay veya > 60 yaş ve teofilin düzeyi > 50 mg/L (278 mmol/l) ise
- Gastrointestinal dekontaminasyon yapılamıyor ise (2D)
3-ECTR’nin kesilmesi :
Klinik iyileşme belirginleştiğinde VEYA teofilin < 15 mg/L (83 mmol/L) olduğunda ECTR’nin kesilmesi önerilir (1D).
4-ECTR Seçimi :
ECTR olarak IHD tercih edilir (1C).
Hemodiyalizin bulunmadığı durumlarda aşağıdakiler kabul edilebilir alternatiflerdir :
Hemoperfüzyon (1C)
CRRT (3D)
Yenidoğanda değişim transfüzyonu HD’ye alternatif olabilir (2D).
Gerekçe : Teofilin klirensini en iyi sağlayan yöntem hemoperfüzyon olsa da, gelişen teknoloji sonucu daha yüksek etkinlikli filtreler, kateterler ve elde edilebilen daha yüksek kan akım hızı neticesinde hemodiyaliz bu farkı neredeyse kapatmıştır.
5-Diğer öneri :
MDAC ECTR süresince devam ettirilmelidir (1D).
Gerekçe : Toksikokinetik olarak ECTR’ye additif etkisi vardır.
Kaynakça :
- Ghannoum, M., Wiegand, T. J, Liu, K. D., Calello, D. P., Godin, M., Lavergne, V., Gosellin, S., Nolin, T. D., Hoffman R. S. Et al. (2015). Extracorporeal treatment for theophylline poisoning: Systematic review and recommendations from the EXTRIP workgroup. Clinical Toxicology (2015), Early Online: 1–15. http://doi.org/10.3109/15563650.2015.1014907
Değerli Acil Tıp Uzmanları;
Üzerinde çalıştığımız projemiz “TOXIPAPER” hayata geçiyor.
Editörlerimiz ve çalışma grubu üyelerimiz her ay güncel, merak edilen ve günlük hayatımızda etkileri olacak makaleleri sizler için derleyip aylık yazılara haline getirecek ve bu yazılar sizlerin takibine sunulacak.
Umarım bu projede her zaman ki enerjinizle bizimle beraber yol almaya,tartışmalara aktif katılmaya ve günlük hayatımızda toksikoloji literatürünü takip devam etmeye hazırsınızdır.
Hazırsanız 15 Aralık 2017 tarihinde bu uzun ömürlü maratona başlıyoruz.
Her birinize şimdiden ilginiz için teşekkür ediyoruz.
Saygılarımızla
Türkiye Acil Tıp Derneği
Toksikoloji Çalışma Grubu adına
[gallery-3]
Cumhuriyetimizin ilanının yıldönümünde,
Büyük Önderimiz Gazi Mustafa Kemal Atatürk”ü, aziz şehitlerimizi ve gazilerimizi saygı ve rahmetle anıyor,
Cumhuriyet Bayramınızı en içten dileklerimle kutluyorum.
Prof. Dr. Arzu Denizbaşı
TATD Toksikoloji Çalışma Grubu Başkanı
|
Yazar: Marmara Üniversitesi Tıp |
İkinci Jenerasyon Banyo Tuzlarından Flakkaİnternette okuduğumuz, medyada zombi hapı adıyla anılan Flakka’dan yine internette gördüğümüz videolar vasıtası ile haberdardık. Ancak Amerika kıtasından buralara gelmesi süre alır diye düşünmüştüm. Ta ki geçen gece kırmızı alandaki madde bağımlısı hasta “Bonzai de neymiş, siz esas Flakka’yı görün! Esas kafa Flakka’da!” diye bağırana kadar. Bundan böyle izlediğim videoların bana artık o kadar da uzak olmadığını anladım. 20.10.2017 tarihinde acilci.net 'te yazdığım 'İkinci Jenerasyon Banyo Tuzlarından Flakka' isimli yazıya bu linki tıklayarak ulaşabilirsiniz.
|
Zehirlenmelerde Ekstrakorporeal Tedaviler Yazı Dizisi – TRİSİKLİK ANTİDEPRESANLAR
Trisiklik antidepresanlar
Genel :
- Etki mekanizması : – Seratonin ve norepinefrinin presinaptik geri alım inhibisyonu
– Muskarinik ve alfa adrenerjik yarışmalı antagonizm ve histamin inhibisyonu, GABA-A antagonizm.
– Kardiyak sodyum kanllarını bloke eder -> tip 1A antiaritmik özellikler
- Gastrointestinal yoldan hızlıca emilir. Doz aşımında antikolinerjik etkiden dolayı emilim yavaşlayabilir, konsantrasyon pik süresi uzayabilir.
- Çok yüksek oranda plazma proteinlerine bağlanır. – alfa-1 asit glikoproteinler ve lipoproteinler.
- Lipofiliktir; serbest ilaç dokulara geçer ve dağılım hacmi geniştir.
- Bu sebeplerden ötürü diyalizabl değildir.
- Karaciğerde metabolize olur.
Klinik :
- Antihistaminik – antikolinerjik etkiler : bilinç bozukluğu => ajitasyon, deliryum, koma.
- Diğer antikolinerjik etkiler : kuru kızarık cilt, taşikardi, ileus, midriazis, üriner retansiyon, hipertermi.
- Nöbet : antikolinerjik etki ve GABA-A antagonizmi.
- Kardiyovasküler etkiler (taşikardi, periferal vazodilatasyon, hipotansiyon): muskarinik ve alfa adrenerjik blokaj sonucu.
- Sodyum kanal blokajı => kompleks aritmiler, AV iletim bozuklukları, miyokardiyal depresyon.
- QRS süresi (>100 ms) ve aVR’de >3mm R dalgası varlığı nöbet ve aritmi gelişimi için alınan ilaç dozundan daha prediktif.
Yönetim :
- Havayolu güvenliği
- Nöbet için -> benzodiazepin
- Erken başvuruda gastrointestinal dekontaminasyon
- Sodyum bikarbonat : hem hipotansiyonu, hem de sodyum yükü ile miyokardiyal iletim bozukluklarını düzeltebilir.
- Alkaloz => ilacın proteine bağlanmasını arttırarak serbest ilaç düzeyini azaltır.
- Hipotansiyon tedavisi için sıvı veya sodyum bikarbonata rağmen devam eden inatçı hipotansiyon için vazopressör.
- Diğer deneysel tedaviler : glukagon, lidokain, magnezyum sülfat, IABP, lipid tedavisi.
Literatür tarama
- Medline, Embase, Cochrane systematic Reviews ve Cochrane Central.
- Veritabanlarında trisiklik veya amitriptilin veya imipiramin veya klomipiramin veya doksepin veya trimipiramin veya amoksapin veya desipiramin veya nortriptilin veya protriptilin veya dibenzepin veya dothiepin veya maprotiline ek olarak; diyaliz veya hemodiyaliz veya hemoperfüzyon veya plazmaferez veya plazma değişimi, değişim transfüzyon veya hemofiltrasyon veya hemodiyafiltrasyon veya ekstrakorporeal tedavi veta CRRT tarandı.
- EAPCCT ve NACCT yıllık toplantı tutanakları manuel olarak tarandı.
- Google scholar ve erişilen makalelerin kaynakçaları tarandı.
- Literatür tarama 1 Kasım 2013’te güncellendi.
Sonuç :
77 makale dahil edildi : 1 gözlemsel çalışma, 5 hayvan çalışması, 4 in-vitro çalışma, 4 farmakokinetik çalışma, 63 vaka bildirimi.
Öneriler :
- Genel : TCA zehirlenmeli hastalarda ECTR yapılmaması önerilir.
Kaynak :
- Yates, C., Galvao, T., Sowinski, K. M., Mardini, K., Botnaru, T., Gosselin, S., et al. (2014). Extracorporeal Treatment for Tricyclic Antidepressant Poisoning: Recommendations from the EXTRIP Workgroup. Seminars in Dialysis, 27(4), 381–389. http://doi.org/10.1111/sdi.12227
Organik fosfat zehirlenmelerinde mortalite ve morbiditeyi etkileyen faktörler nelerdir?
Organik fosfor bileşikleri tüm dünyada yaygın olarak kullanılan insektisitlerdir. Vektör seçiciliği düşük, toksisiteleri çok yüksek olan bu grup bileşikler, insanlarda ölümcül zehirlenmelere neden olabilir. Bu ilaçların yağda çözünürlüğü yüksek, emilimleri hızlıdır. İnhalasyonla bile zehirlenmeye yol açabilirler. İnhalasyonla bu denli zehirlenmeye yol açabildikleri için, bu bileşikler kimyasal silah olarak da kullanılmıştır.
Organik fosfat bileşikleri, özellikle Türkiye gibi gelişmekte olan tarım ülkelerinde, özkıyım amacıyla yaygın olarak kullanılmaktadır. Bu bileşiklerin antidotu olsa da, halen mortal olabilen çok ciddi zehirlenme tablosuna sebebiyet verirler. Organik fosfat bileşikleri Asetilkolinesteraz (AChE) enzimini baskılayarak kolinerjik sendroma neden olur. Parçalanamayan asetil kolinin muskarinik ve nikotinik alanda birikimi sonucunda semptomlar ortaya çıkar. Kolinerjik Sendrom ölümle sonuçlanabilen ciddi bir zehirlenme tablosuna yol açar.
Kolinerjik Sendrom(SLUDGE, DUMBELS, Killer B’ees)
Asetil Kolinin Muskarinik Alanda Birikimi Sonucu
| DUMBELS
Diyare Urinasyon Miyozis Bronkore, Bronkospazm Emezis Lakrimasyon Salivasyon |
SLUDGE
Salivasyon Lakrimasyon Urinasyon Defakasyon Gastrointestinal pain Emezis |
| Killer B’ees | |
| Bradikardi, Bronkospazm, Bronkore | |
Asetilkolinin Nikotinik Alanda Birikimi
|
|
|
|
|
Atropin ve Pralidoksim antidot olarak kullanılmaktadır ve çoğu vakada etkin tedaviyi sağlar. Normalde organik fosfat bileşikleri asetilkolinesterazın aktif bölgesindeki serin aminoasidinin hidroksil grubuna kovalent bağ ile bağlanarak enzimi baskılar. Bu bağ geçici bir süre için geri dönüşümlüdür. Fakat fosfat molekülünden bir grup ayrıldığında geri dönüşümsüz hale gelir. Bu durum “aging(yaşlanma)” olarak adlandırılır. Yaşlanma zamanları her bileşik için farklıdır, dakikalardan günlere kadar değişebilir. Organik fosfat zehirlenmesi olan hastalarda enzimde yaşlanma olmadan erken dönemde Pralidoksim tedavisi önerilmektedir.
Fakat Atropin ve PAM, ne kadar erken dönemde ve uygun dozda verilse de, özellikle diazinon(Basudin) gibi ajanlarda, enzimde erken yaşlanma (dakikalar içinde) gelişimi nedeniyle, tedavisi sağlanamayan, solunum yetmezliğiyle uzun dönem mekanik ventilatör ihtiyacı olan, yoğun bakım takibi gerektiren ve bu süreçte kaybedilen vakalar mevcuttur. Eddleston M ve ark’nın, 376 hastalık bir çalışmasında, OF ile zehirlenmiş 90(%24) hastanın, entübasyon ve mekanik ventilasyon ihtiyacı olduğunu, hastaların 52(%58)’sinin ilk 2 saat, geriye kalan hastaların ise, 24 saat sonraki dönemde entübasyon gerektirdiğini ifade etmişlerdir.
Tüm teknolojik gelişmelere rağmen, ‘mekanik ventilasyon gerektiren’ organik fosfat zehirlenmeli hastaların halen %10’u (Yapılan çalışmalarda mortalite oranları, Muley ve ark. %10.52, Atlı ve ark. %12.8, Kang ve ark. %20.6 .) kaybedilmektedir.
*** Tüm teknolojik gelişmelere rağmen, vakaların %10’nu neden ölüyor?
Organik fosfat zehirlenmesinde mortaliteyi etkileyen birçok faktör bulunmakla beraber, genelde ölüm nedenleri arasında akut kolinerjik kriz, intermediate sendrom gibi solunum yetmezliği yapan durumlar ön plandadır. Literatürdeki mortalite belirteçleri ile ilgili çalışmalara bakıldığında,
Solunum yetmezliği, mekanik ventilatör ihtiyacının olması
GCS, SOFA, APACHE 2, SAPS gibi skorlama sistemi puanlarının kötü olması
Hastanın Body Mass indeksinin(BMI) yüksek olması
PKE düzeylerinin düşük seyretmesi ve ilk 3-5 günde yükselmemesi
Bazı biyokimyasal(Glukoz, kreatinin vb.) ve inflamatuar yanıt parametreleri, RDW değeri yüksekliği gibi birçok parametre belirtilmiştir.
Fakat mortalitenin en güçlü belirteci olarak akut dönemde olan solunum yetmezliğinin devam etmesi, ya da intermediate sendrom gelişmesi gösterilmiştir.
İntermediate Sendrom
| Zehirlenmeden 24-96 saat sonra |
| Akut kolinerjik krizin iyileşmesini takiben ve gecikmiş nöropatinin başlangıcından önce |
| Boyun fleksör kasları, solunum kasları ve proksimal ekstremite kaslarını etkileyen kas güçsüzlüğü |
| Göz kaslarını uyaran sinirler, 7 ve 10. kraniyal sinir tutulumu |
| Solunum güçlüğü, solunum yetmezliği, ölüm |
| Parathion, diazinon, malathion, fenthion, dimethoate ile sık |
İntermediate Sendromda Sorumlu Mekanizmalar
| Yağ dokusundan yeniden salınma |
| Aging(yaşlanma), Uzamış AKE baskılanması |
| Yetersiz oksim tedavisi |
| Postsinaptik asetilkolin reseptörlerinin duyarsızlaşması |
| Postsinaptik asetilkolin salınımında yetersizlik |
Organik fosfat zehirlenmeli hastaların, tipik kolinerjik bulguları (Sekresyon artışı, miyozis vb.) atropinle ve PAM’la düzelmesine rağmen, özellikle enzimde yaşlanma mevcutsa, solunum yetmezliği ve solunum kas güçsüzlüğünün düzelmediği, bu nedenle uzun süre mekanik ventilasyon ihtiyacı olduğu bilinmektedir.
Solunum yetmezliği tablosunun erken dönemde akut kolinerjik kriz, geç dönemde (24 saat sonra) intermediate sendrom, daha ileri evrede periferik solunum kas gücü yetersizliğine bağlı olabileceğini, bu klinik sendromların her zaman tam ayrıştırılamayacağı, fakat hekimlerin özellikle ilk 6 günde solunum yetmezliği yönünden çok dikkatli olması gerektiğini bildiren çok sayıda yayın mevcuttur.
Organik Fosfat Zehirlenmelerinde Solunum Yetmezliği Tablosunun Sık Karşılaşılan Nedenleri
|
|
|
|
|
|
OF zehirlenmeli hastaların mekanik ventilator süreci yanında, morbidite ve mortaliteye sebebiyet veren başka bir sorunda, özellikle koroner arter hastalığı, diabet, hipertansiyon gibi komorbidite yaratan durumlardır. Atropin dozunun arttırılıp kolinerjik bulguların kaybolduğu dozlarda, bu hastalarda kalp hızı ve oksijen tüketiminin artmasıyla tetiklenen akut koroner sendrom, zehirlenen ajanın toksisitesi (uzun QT) ve akut koroner sendroma bağlı ortaya çıkan aritmiler (VT, SVT, Yüksek ventrikül cevaplı AF vb.), bu nedenle atropin dozunun azaltılmasıyla kolinerjik bulguların yinelemesi, aşılması zor bir kısır döngü yaratmaktadır. Diyabetik hastalarda ise ajanın toksisitesi bağlı, (diabetik olmayan hastalarda bile hiperglisemiye sebebiyet verebilir) dirençli hiperglisemi, enfeksiyona yatkınlık sonucu ortaya çıkan enfeksiyöz durumlar, septik hadiseler de mortalite nedeni olabilmektedir.
Tedaviye dirençli, morbidite ve mortalite riski olan, kötü prognostik kriterlere sahip hastalarda, ekstrakorporeal çıkarım metotları geç kalmadan düşünülmelidir.
Yapılan çalışmalarda, organik fosfat zehirlenmeli hastalarda, ekstrakorporeal çıkarım metodu olarak tedavi amaçlı plazma değişimi (Therapeutic Plasma Exchange) uygulanan vakalar mevcuttur.
Total Plasma Exchange (TPE) için uygun zaman ve hasta seçimi nasıl olmalı?
Literatürde organik fosfat zehirlenmelerine bağlı ekstrakorporeal çıkarım metodu olarak tedavi amaçlı plazma değişimi uygulanan vakalar ve vaka serileri mevcuttur. Bu hastalardan, uygun vaka ve uygun zaman nedir sorusu, aslında tüm zehirlenmelerde olduğu gibi, klasik tedavi metotları ve antidot tedavisine yanıt vermeyen hastalar olarak cevaplanabilir. Fakat OF bileşikleri, uzun soluklu, çoğu zaman ortalama 3 günden önce iyileşmeyen bir zehirlenme tablosuna yol açar. Bu nedenle uzun tedavi sürecinde, komplikasyonlar gelişmeden, gereken vakalara erken dönemde TPE uygulamak önem arzeder. TPE için hasta seçiminde literatürdeki yayınlar tarandığında;
Antidot tedavisine rağmen solunum yetmezliği ilk 3-5 günde düzelmeyen
Yüksek komorbiditesi olan hastalar(DM, HT, Obezite, Koroner arter hastalığı vb.)
Solunum yetmezliği ile birlikte Psödokolinesteraz düşüklüğü sebat eden hastalar
Özellikle kreatinin değeri yükselen, akut organ yetmezliği bulguları ortaya çıkmaya (MODS) başlayan hastalarda çokta gecikmeden TPE uygulamasının yapılması önerilir.
Bu uygulama;
Aslında hastanın plazmasının değişimidir. Zehirlenmelerde ekstrakorporeal çıkarım tekniklerine bakıldığında, suda çözünen büyük moleküllü maddelerin hemodializle, plazma proteinlerine yoğun olarak bağlanan küçük moleküllü, suda çözünmeyen ajanların ise TPE ile tedavi edilmesi önerilmektedir.
Organik fosfatlar, proteinlere yoğun olarak bağlanabilen, suda çözünmeyen, yağda birikebilen ve tekrar tekrar salınarak zehirlenme yapabilen ajanlar olduğu için, TPE uygulaması önerilmektedir.
TPE santral venöz katetere ihtiyaç duyulmaksızın, 2 geniş periferik damar yoluyla yapılabilen bir uygulamadır. TPE’nin, plazma proteinlerine yoğun olarak bağlanan, dağılım hacmi düşük zehirlenmelerde, etkin tedavi edici özelliği bulunmaktadır. TPE hastanın kanının, tıbbi bir cihazdan geçirilerek, diğer kan bileşenlerinden ayrıldığı, ayrılan plazma yerine, yeni plazma, albümin, kristaloid/kolloid solüsyonla birleştirilerek verildiği bir işlemdir. Böylece plazmada serbest ya da proteinlere bağlı ilaçların bir kısmı bu yöntemle vücuttan uzaklaştırılabilmektedir. Bu işlem tek sefer yapılabileceği gibi, klinik düzelene kadar tekrarlanabilmektedir. Dağılım hacmi çok geniş ilaçlarda, başarı elde edilemeyebilir.
Yapılan çalışmalarda, klasik metotlarla iyileşmeyen, organik fosfat zehirlenmesi nedeniyle TPE uygulanan hastaların büyük bir kısmında, ilaçtan veya maddeden arınmış yeni plazmayla iyileşme sağlanabildiği görülmüştür.
Sonuç olarak, organik fosfat zehirlenmeleri halen morbidite ve mortalitesi yüksek zehirlenmelerdir. Prognozunun kötü olacağı öngörülen hastalarda, klasik metotlarla tedavi sağlanamıyorsa, ölümcül komplikasyonlar gelişmeden, TPE’nin erken dönemde uygulanması düşünülebilir.
Kaynaklar
- King AM, Aaron CK. Organophosphate and carbamate poisoning. Emerg Med Clin North Am. 2015 Feb;33(1):133-51
- Hrabetz H, Thiermann H, Felgenhauer N, Zilker T, Haller B, Nährig J, Saugel B, Eyer F. Organophosphate poisoning in the developed world – a single centre experience from here to the millennium. Chem Biol Interact. 2013 Dec 5;206(3):561-8. doi: 10.1016/j.cbi.2013.05.003. Epub 2013 May 17.
- Muley A, Shah C, Lakhani J, Bapna M, Mehta J. To identify morbidity and mortality predictors in acute organophosphate poisoning. Indian J Crit Care Med. 2014 May;18(5):297-300. doi: 10.4103/0972-5229.132488.
- Atlı M, Sebe A, Ay MO, Karanlık M, Açıkalın A, Kozacı N, Yılmaz M, Satar S. The Relationship Between Electrocardiographic ChangesCholinesterase Levels and Mortality in Acute Organophosphate Poisoning. Cukurova Medical Journal,2013; 38 (2):181-188.
- Kang C, Park IS, Kim DH, Kim SC, Jeong JH, Lee SH, Lee SB, Jung SM, Kang TS, Lee KW. Red cell distribution width as a predictor of mortality in organophosphate insecticide poisoning. Am J Emerg Med. 2014 Jul;32(7):743-6. doi: 10.1016/j.ajem.2014.02.048. Epub 2014 Mar 6.
- Kozacı N, Açıkalın AA, Satar S, İçme F. Causes of death treatment of organophosphorus pesticide poisoning. JAEM 2012;11: 176-82
- Leibson T, Lifshitz M. Organophosphate and carbamate poisoning: review of the current literature and summary of clinical and laboratory experience in southern Israel. Isr Med Assoc J. 2008 Nov;10(11):767-70. Review.
- Eddleston M, Mohamed F, Davies JO, Eyer P, Worek F, Sheriff MH, Buckley NA. Respiratory failure in acute organophosphorus pesticide self-poisoning. QJM. 2006 Aug;99(8):513-22. Epub 2006 Jul 22
- Vijayakumar S, Fareedullah M, Ashok Kumar E, Mohan Rao K. A prospective study on electrocardiographic findings of patients with organophosphorus poisoning. Cardiovasc Toxicol. 2011 Jun;11(2):113-7. doi: 10.1007/s12012-011-9104-4.
- King AM, Aaron CK. Organophosphate and carbamate poisoning. Emerg Med Clin North Am. 2015 Feb;33(1):133-51. doi: 10.1016/j.emc.2014.09.010. Epub 2014 Nov 15.
- Rehiman S, Lohani SP, Bhattarai MC. Correlation of serumcholinesterase level, clinical score at presentation and severityof organophosphorous poisoning. JNMA J Nepal Med Assoc 2008;47:47-52.
- Gazzi EN, Sorodoc V, Petris O, Tarţău L, Dumitrescu G, Sorodoc L, Lupuşoru CE. Butyrylcholinesterase activity-biomarker for predicting the outcome in acute cholinesterase inhibitor poisoning–a 30-year retrospective analysis. Rev Med Chir Soc Med Nat Iasi. 2014 Oct-Dec;118(4):971-8.
- Moon J, Chun B. Utility of red blood cell acetylcholinesterase measurement in mechanically ventilated subjects after organophosphate poisoning. Respir Care. 2014 Sep;59(9):1360-8. doi: 10.4187/respcare.02916. Epub 2014 May 27.
- Sun IO, Yoon HJ, Lee KY. Prognostic Factors in Cholinesterase Inhibitor Poisoning. Med Sci Monit. 2015 Sep 28;21:2900-4. doi: 10.12659/MSM.894287.
- Yılmaz M, Sebe A, Ay MO, Gümüşay U, Topal M, Atlı M, İçme F, Satar S. Effectiveness of therapeutic plasma exchange in patients with intermediate syndrome due to organophosphate intoxication. American Journal of Emergency Medicine, 31 (2013) 953–957
- Dişel NR, Akpınar AA, Sebe A, Karakoç E, Sürer S, Turhan FT, Matyar S. Therapeutic plasma exchange in poisoning: 8 years’ experience of a university hospital. Am J Emerg Med. 2015 Oct;33(10):1391-5. doi: 10.1016/j.ajem.2015.07.016. Epub 2015 Jul 17.
- Acikalin A, Dişel NR, Matyar S, Sebe A, Kekec Z, Gokel Y, Karakoc E. Prognostic Factors Determining Morbidity and Mortality in Organophosphate Poisoning. Pak J Med Sci. 2017 May-Jun;33(3):534-539. doi: 10.12669/pjms.333.12395.