5 Haziran 2023’de Prof. Dr. Cuma Yıldırım’ın konuşmacı olduğu Yılan Isırıkları ve Akrep Sokmaları webinarımız Prof. Dr. Ayça Açıkalın Akpınar moderatörlüğünde gerçekleşmişti.
Kaçıranlar veya yeniden izlemek isteyenler için linkimiz

05 Haziran 2023 saat 20.00’de Prof. Dr. Cuma Yıldırım’ın konuşmacı olduğu Yılan Isırıkları ve Akrep Sokmaları webinarımız Prof. Dr. Ayça Açıkalın Akpınar moderatörlüğünde gerçekleşecektir.

Webinara katılmak için zoom linkine sitemizden ulaşabilirsiniz: https://tatd.org.tr/tatdem/kurs/yilan-isiriklari-ve-akrep-sokmalari-webinari-5-haziran-2023/
Diğer tüm detaylar için:
https://tatd.org.tr/toksikoloji/
adresini ziyaret edebilirsiniz.
Çocukluk çağında zehirlenmeler yüksek mortalite ve morbidite ile seyreden klinik durumlardır. WHO verilerine göre kaza ile oluşan zehirlenmelerin içinde çocukluk çağında oluşan zehirlenmelerin oranı toplam nüfus içerisinde %13’ tür. Yine çocukluk çağındaki tüm zehirlenmeler içinde alımların %40’ ı maksatlı alımlardır ve erkek çocuklarda kız çocuklara göre daha fazla görülür. Acil servislerde çocukluk çağındaki zehirlenmeleri detaylı analiz etmek her zaman mümkün olmayabilir. Çünkü çoğunlukla yeterli zaman veya ortam mevcut değildir. Çoğu zehirlenen çocukta etken madde belli olmadan destek tedavisi yapılır. Klinikte çocuk hastalarda belli toksidromlarda antidot kullanımlarının uygulandığını görmekteyiz. Kam Lun Hon ve arkadaşlarının 2021 yılında yayınladığı bir derleme makalesinde çocukluk çağında antidot kullanımları hakkında yapılan önerileri görüyoruz.
İlk Yaklaşım
Tüm hasta gruplarında olduğu gibi Acil Tıpta zehirlenmiş çocuk hastalara yaklaşım havayolu stabilizasyonu ile başlar. Dolaşım ve solunum parametrelerinin stabilizasyonu her tedaviden önce gelir. Dekontaminasyon tekniklerinin uygulanabileceği tüm hastalarda özellikle gastrointestinal dekontaminasyon yapılmalıdır. Klinikte mevcut olan toksidrom varsa mutlaka tedavide hedef ona göre belirlenmelidir; çoklu ilaç veya toksin alımlarında etkileşimlerin olması, emilim ve dağılımda gecikmeler toksidromların tanınmasını güçleştirebilir.
1. Antikolinerjik toksikdromlar ve antidot olarak fizostigmin
Antikolinerjikler, asetilkolinin santral sinir sistemindeki (SSS) muskarinik reseptörlere ve parasempatik sinir sistemindeki reseptörlere bağlanmasını inhibe ederek etki ederler. Bir antikolinerjik ajan ile zehirlenme sonucunda taşikardi, hipertermi, non- reaktif, anhidroz, mukozaların kuruması, ciltte kızarma, barsak seslerinde azalma ve idrar retansiyonuna neden olabilir. SSS’ deki antikolinerjik etkiler ile deliryum, konfüzyon, anksiyete, ajitasyon, anlamsız mırıldanmalar, görsel halüsinasyon ve psikoz gelişebilir. SSS’deki toksik etkiler genellikle periferik etkilerden daha uzun sürer çünkü ilaçların lipofilik özelliklerinden dolayı yağda dağılım hacmi yüksektir. Anhidroz, midriyazis, ciltte kızarma, hipertermi ve deliryum çocukta antikolinerjik zehirlenmelerde önemli bulgulardır. Bu zehirlenmelerin pek çoğu pediatrik viral hastalıkların semptomatik rahatlaması için kullanılan dekonjestan amaçlı ilaçlar nedeniyle olmaktadır.
Fizostigmin spesifik olarak antikolinerjik madde zehirlenmelerinde kullanılan antidottur. Fizostigmin asetilkolinesterazı inhibe eder. SSS’ de ve periferik sinir sisteminde asetilkolin seviyesini artırır. Antikolinerjik toksisitesi olan çoğu hasta iyi durumda olduğu için tek başına destekleyici bakım ile düzelir. Ama periferik sinir sistemi ve SSS bulguları olan hastalarda fizostigmin kullanılmalıdır. Etki başlangıç süresi 5–10 dakikadır ve önerilen doz erişkinler için 0,5–2 mg ve çocuklar için 0,02 mg/kg (maksimum 0,5 mg)‘dır. İlaç 5 dakika boyunca yavaş intravenöz bolus ile uygulanır. Ciddi zehirlenmelerde tekrarlayan dozlar gerekebilir. Altta yatan trisiklik antidepresan kullanımı olan veya uzamış QT aralığı olan hastalarda aritmi açısından takip etmek gerekir.
2. Karbon monoksit zehirlenmesi ve tedavisi için hiperbarik oksijen tedavisi
Karbonmonoksit renksiz, kokusuz, irritan olmayan ve tatsız bir gazdır. Karbon içeren yakıtların veya kömürün eksik yanması sonucunda ortama salınır. Karboksihemoglobin (COHb) molekülü eritrositlerde hemoglobin ile karbon monoksit temas ettiğinde oluşur. COHb oluşumu sonrasında hemoglobin oksijen molekülünü bağlayamaz, dokuya veremez ve doku düzeyinde hipoksi oluşur. Ayrıca karbonmonoksit molekülü sitokromlara, miyoglobuline ve guanilil siklaza bağlanarak doğrudan hücresel toksisiteye neden olur.
Zehirlenmede semptomlar ve bulgular karbon monoksit zehirlenmesi için spesifik değildir ve COHb’nin kandaki düzeyine bağlı olarak değişir. Düşük seviyelerde olan çocuklarda baş ağrısı, baş dönmesi, halsizlik ve bulantıya neden olur. Düzey %20’ nin üzerine çıktığı zaman kusmaya, görme bozukluğuna, mental değişikliklere ve geçici bilinç kaybına neden olur. Düzey %50’nin üzerine çıkınca koma ve nöbet gibi ağır tablolar çıkar. Standart pulse oksimetresi (SpO2) ve arteriyel kısmi oksijen basıncı (PaO2) ölçümleri yararlı değildir. Düzey takibi gerekmektedir. Komplikasyonlar olarak ventriküler aritmiler, miyokardiyal iskemi, pulmoner ödem, laktik asidoz ve nöropsikiyatrik sendromlar oluşur. Nöronal dokusu gelişmekte olan bir çocukta bu zehirlenme önemli sorunlara neden olabilir.
3. Kolinerjik toksidromlar ve antidot olarak atropin
Asetilkolin, muskarinik ve nikotinik reseptörler üzerinden etki eden bir nörotransmitterdir.
SSS otonom sinir sistemi ve nöromüsküler kavşaktaki reseptörlerdeki etkileri asetilkolinesteraz enzimi tarafından düzenlenir. Kolinerjik toksidromlar organofosfat veya karbamat içeren pestisitlere, sinir gazına, ekotiyofat, piridostigmin, donepezil ve takrin içeren ilaçlara veya bazı mantar türlerine maruz kalmak sonucunda (örn. Inocybe rimosa, Clitocybe türleri kolinerjik zehirlenmeye de neden olur) oluşur.
Muskarinik reseptörlerin uyarılmasının neden olduğu semptomlar SLUDGE/ BBB olarak özetlenebilir (salivasyon, gözyaşı artışı, idrara aşırı çıkma, dışkılama, gastrointestinal kramp, kusma/bradikardi, bronkore, bronkospazm). Nikotinik reseptörlerin uyarılması kas fasikülasyonları, flaccid felç, bradiaritmi, deliryum, nöbet ve komaya neden olur. Çocuklarda özellikle karbamat ve organofosfat ile ilgili zehirlenmelerde hipotoni, stupor ve koma gibi SSS bulguları beklenir.
Atropin, kolinerjik zehirlenmelerde kullanılan antidottur. Muskarinik reseptörlerde asetilkolinin kompetetif antagonistidir. Nikotinik reseptörler üzerinde etkisi yoktur. Tavsiye edilen atropin dozu, yetişkinler için intravenöz olarak verilen 1-5 mg’ dır. Pediatrik hastalarda, 0,01–0,03 mg/kg doz verilir. Dozlar her 3–5 dakika klinik cevaba göre tekrar edilir. Maksimum kümülatif intravenöz doz çocuklarda 1 mg ve ergenlerde 2 mg’dır. Sürekli infüzyon olarak atropin tedavisi de uygulanabilir. Artan dozlar ile infüzyon tedavisine geçmek konvansiyonel bolus atropin dozlarını vermeye kıyasla daha düşük mortalite, daha düşük ventilasyon desteği gereksinimini sağlar. Atropin ayrıca kolinerjik doz aşımı olan çocuklarda nöbetleri kontrol altına almak için benzodiazepin ile kombinasyon halinde kullanılabilir. Atropin nikotinik etkisi olmadığı için nikotinik reseptörler ile ilgili semptomlara yardımcı olmaz.
4. Kolinerjik toksidromlar ve antidot olarak Pralidoksim
Pralidoksim organofosfat zehirlenmesi için kullanılan antidottur. Organofosfat-asetilkolinesteraz kompleksini parçaladığı ve enzimi serbest bıraktığı için zehirlenmeye neden olan asetilkolin birikimini degrade eder. Hem muskarinik hem de nikotinik semptomlar üzerinde etkilidir. Pralidoxime atropine ek bir tedavi olarak kullanılır. Monoterapi olarak Pralidoksim semptomları şiddetlendirebilir çünkü oksim kaynaklı asetilkolinesteraz inhibisyonu yapar ve enzimin çalışmasını engeller. Önerilen intravenöz pralidoxime dozu erişkinde 1-2 g ve çocuklarda 25–50 mg/kg’dır. Dozlar maksimum 2 g olmalı ve 30 dakikanın üzerinde verilmelidir. Sürekli infüzyon ayrıca kullanılabilir ve boluslara göre daha iyi klinik yanıtla ilişkilendirilebilir. Pralidoxime yan etkileri çocuklarda nadir görülür ve hipertansiyon, baş ağrısı, bulanık görme, mide bulantısı ve kusma olarak sayılabilir.
5. Siyanür zehirlenmesi ve antidot olarak sodyum nitrit, sodyum tiyosülfat ve hidroksokobalamin
Siyanür zehirlenmesi, renksiz hidrojen siyanür gazının solunması veya sodyum siyanür veya potasyum siyanür tuzları olarak yutulması ile maydana gelir. Duman inhalasyonu yoluyla karbon ve nitrojen içeren maddelerin yanması ile önemli bir siyanür toksisitesi mekanizması olabilir. Diğer siyanür kaynakları kayısı çekirdeği yutulması, kazara kullanılan kimyasalların tüketimi veya madencilik endüstrisinde kullanılan maddelerin alımı ile olabilir. Siyanür toksisitesi sitokrom oksidazın ferrik iyonuna bağlanmasından meydana gelir. Siyanür zehirlenmesi ile hücresel hipoksi, anaerobik metabolizma ve laktik asidoz gelişir.
Siyanür toksisitesinin klinik belirti ve bulguları genellikle spesifik olmayan ve klinik belirtiler arasında anksiyete, baş ağrısı, kusma, karın ağrısı, göğüs ağrısı, konfüzyon, acı badem kokusu, kiraz kırmızısı cilt, midriyazis, taşipne, taşikardi, aritmi, bulanık görme, bilinç kaybı
ve nöbetlerdir. Kardiyojenik şok tablosu gelişebilir. Siyanür zehirlenmesinin komplikasyonları pulmoner ödem, kardiyopulmoner kollaps, rabdomiyoliz, akut böbrek hasarı, hepatik nekroz ve hatta ölümdür. Tanı koymak, yüksek şüphe gerektirir ve akut dönemde kan siyanür seviyesi genellikle yardımcı değildir. Alternatif tanı ajanı olarak, bir plazma laktat seviyesinin ≥10 mmol/L olması ve maruziyet düşündürücü bir öykü siyanür zehirlenmesi olasılığına karşı uyarır.
Sodyum nitrit, sodyum tiyosülfat ve hidroksokobalamin siyanür toksisitesi için kullanılan antidotlardır ve birlikte uygulabilirler. İntravenöz sodyum nitrit 300 mg yetişkinler için veya çocuklar için 6 mg/kg (maksimum doz 300 mg) verilmesi siyanürü sitokrom oksidazın bağlanmasından uzaklaştırır. Oluşan siyanomethemoglobin formu tiyosülfat (250 mg/kg, verilen maksimum doz 12,5 g) ile kombine olarak böbrekten atılabilir.
Antidot olarak hidroksokobalamin alternatif bir panzehirdir, siyanür için sitokromdan daha yüksek bir afiniteye sahip olarak bağlanır. Önerilen hidroksokobalamin dozu yetişkinler için 5 g ve çocuklar için 70 mg/kg’dır. Maksimum 5 g intravenöz olarak verilir.
6. Hipnotik/ sedatif toksidromlar ve antidot olarak flumazenil
Sedatif ve hipnotik toksidrom konuşma bozukluğu, ataksi, koordinasyon ve oryantasyon bozukluğu ile presente olabilir. Şiddetli toksisitesi olanlarda stupor ve koma da görülebilir. Sedasyon uygulananlarda hipoventilasyon nadirdir. Benzodiazepin’in oral formunun doz aşımı ile hipoventilasyon ve miyozis pek görülmez. Bu sayede opioid zehirlenmesinden daha kolay ayrılırlar. Ancak hafif bradikardi, hipotansiyon ve solunum depresyonu intravenöz benzodiazepin doz aşımında meydana gelir. Spesifik olarak, benzodiazepin doz aşımı olan çocuklarda ataksi ve uyuşukluk meydana gelir; solunum depresyonuna daha az rastlanır.
Flumazenil, kompetetif bir benzodiazepin antagonistidir. Benzodiazepin veya benzodiazepin olmayan zolpidem gibi ilaçlarla olan zehirlenmelerde antagonist olarak kullanılır. Başlangıç dozu IV 0,2 mg’dır. Yetişkinler için 0,01 mg/kg ve çocuklar için (maksimum 0,2 mg) intravenöz olarak verilir. Doz artışı ile tekrarlanan dozlar klinik cevaba göre verilebilir. Maksimum doz genellikle 1 mg’dır, ancak 2,5 – 10 mg gibi daha yüksek dozlar bildirilmiştir. Flumazenil’in ayrıca altta yatan nöbetleri hızlandırabileceğine dikkat edilmelidir.
7. Methemoglobinemi ve antidot olarak metilen mavisi
Methemoglobinemi genel olarak konjenital veya edinsel olarak sınıflandırılır. Konjenital formu sitokrom b5-methemoglobin eksikliğine bağlı gelişebilir. Ya da mutant globin nedeniyle hemoglobindeki Fe+2 bölgesinin Fe+3 yani ferrik duruma kendiliğinden oksidasyonu ile gelişir. Edinsel nedenler arasında kimyasallara maruz kalma (örn. nitratlar, nitritler, anilin, fenilhidroksilamin, aminofenol, asetanilit), bazı gıdalar (örn. nitrit içeren sebzeler veya baklagiller), herbisitler, pestisitler, ilaçlar (örn. Klorokin, dapson), topikal anestezik ajanlar (örn. Benzokain, lidokain) ve inhale nitrik oksit bildirilmiştir.
Methemoglobinemide MetHb >1,5 g/dL çıktığında hastada siyanoz gelişir. Klinik belirtiler edinsel methemoglobinemide MetHb düzeyine bağlıdır. Aşırı miktarda nitrit tüketen bebeklerde methemoglobinemi belirgin siyanoz ile kendini gösterebilir ve bu “mavi bebek sendromu” olarak tanımlanır. Anksiyete, baş ağrısı ve baş dönmesi>%20 MetHb seviyelerinde oluşabilir. Yorgunluk, kafa karışıklığı ve takipne %30-50 MetHb seviyelerinde meydana gelebilir. Aritmi, nöbetler ve koma ise>%50 MetHb düzeylerinde meydana gelebilir. Methemoglobinemi tanısı genellikle klinik gözlem üzerine akla gelmelidir. Ani siyanoz başlangıcı olan bir hastada şüpheli maruziyet öyküde varsa ve oksijen tedavisine yanıt vermeyen bir klinikte ise methemoglobinemi akla gelmelidir. Kan gazı analizlerinde pulse oksimetre ile kan gazı arasındaki düzeylerde saturasyon farkı çıkar. Kesin tanı için MetHb düzeyine bakmak gerekir.
Edinsel methemoglobinemi tedavisinde metilen mavisi kullanılmaktadır. Metilen mavisi MetHb’yi temizlemek için NADPH-MetHb redüktaz aktivitesini hızlandırır. Standart metilen mavisi dozu 1-2 mg/kg’dır. Bu doz infüzyon olarak 5 dakikada verilir. Semptomlar devam ederse bir daha tekrarlanabilir ama tavsiye edilen doz aşılmamalıdır. Tedavi sonrası idrar rengi mavimsi yeşile döner. Rebound fenomen olabileceği için MetHb konsantrasyonunun izlenmesi önerilir. Metilen mavisi glukoz-6-fosfat dehidrojenaz (G6PD) eksikliği olan çocuklarda kontrendikedir. Bu çocuklar için metilen mavisi kontrendike olduğundan askorbik asit kullanılmalıdır.
8. Opioid toksidrom ve antidot olarak nalokson
Küçük çocuklarda opioid zehirlenmesi en çok evde opiod türevi ilaçların veya yasadışı kazayla yutulması ile meydana gelir. Piyasada sık bulunan kodein içeren ilaçlardan >1 mg/kg’a maruz kalan çocuklarda yuttuktan sonraki 1 saat içinde toksisite geliştirebilir. Miyosis, opioid doz aşımında önemli bir bulgudur. Yine de opioid doz aşımının spesifik bir belirtisi ve tanısı değildir ve tanı sadece bu bulguya dayanarak yapılmamalıdır. Diğer klinik belirtiler arasında solunum depresyonu, CNS depresyonu, hiporefleksi, kas sertliği, bradikardi, hipotansiyon, kızarma, kaşıntı ve barsak seslerinde azalma sayılabilir. Hipoventilasyon en önemli komplikasyondur ve mortaliteye yol açar. Diğer komplikasyonlar arasında erişkinde amenore, bozulmuş doğurganlık, kardiyojenik olmayan pulmoner ödem, akut rabdomiyoliz ve akut böbrek hasarı gösterilir. Unutulmamalıdır ki çocuklarda opioid doz aşımı durumunda, gecikmiş bir toksisite başlangıcı gösterebilir ve klinik etkiler daha şiddetli ve uzun süreli olabilir.
Nalokson, sentetik bir opioid reseptörü antagonistidir ve opioid toksidromun hem tanı hem de tedavisinde kullanılmaktadır. Etkisi hızlı başlar ve intravenöz, intramüsküler, intranazal veya endotrakeal yoldan verilebilir. İntravenöz yol tercih edilmelidir. Nalokson solunum ve CNS depresyonunu tersine çevirmede etkilir. Erişkinler ve adolesanlarda intravenöz doz 0,4- 2 mg’dır. Bu doz her 3- 5 dakikada bir solunum depresyonu düzelene dek tekrarlanabilir. Maksimum toplam doz 10 mg’ dır. Çocuklar için önerilen başlangıç dozu 0,01 mg/kg intravenöz olarak verilir. Çocukta maksimum toplam doz olana 0,1 mg/kg’a kadar artırılabilir
9. Parasetamol zehirlenmeleri ve antidot olarak N-asetil sistein
Çocuklarda parasetamol zehirlenmesi hem kasıtlı aşırı dozdan hem de kasıtsız tüketim ve ilaç dozu hatasından oluşabilir. Altı yaş altındaki çocuklarda 200 mg/kg’lık tek doz veya 75 mg/kg/gün’ den fazla tüketim toksisite geliştirebilir. Çocuklar ilk önce asemptomatik olabilir ama hepatotoksisite ve karaciğer yetmezliği beklenmelidir. Tedaviye başlama için genel kabul gören yöntem Rumack–Matthew nomogramına göre karar vermektir. N-asetilsistein, tedavi etmek için kullanılan bir ilaçtır. Asetilsistein karaciğerdeki tükenmiş glutatyon rezervlerini yenileyerek ve asetaminofenin toksik olmayan metabolizmasını artırarak etkisini gösterir. Erişkinde kullanılan intravenöz veya peroral protokoller için çocuklarda kiloya göre kullanım benzerdir.
Standart 21 saatlik rejim <40 kg altındaki çocuklarda şu sırayla uygulanır;
İlk infüzyon: (3 mL=300 mg ampul), 150 mg/kg (40 mL’e tamamlanıp %5 dekstroz veya %0,9 NaCl ile dilüe edilerek) 1 saat IV infüzyon. İkinci infüzyon: 50 mg/kg (320 mL’e tamamla 4 saat IV). Üçüncü infüzyon: 100 mg/kg (320 mL’ye tamamlanıp 16 saat IV)
Standart 21 saatlik rejim >40 kg üzerindeki çocuklarda şu sırayla uygulanır;
İlk infüzyon: (3 ml=300 mg ampul), 150 mg/kg naksimum 16.5 gr (200 mL’e tamamlanıp %5 dekstroz veya %0,9 NaCl ile dilüe edilerek )1 saat IV infüzyon. İkinci infüzyon: 50 mg/kg (500 mL’ye tamamla 4 saat IV). Üçüncü infüzyon: 100 mg/kg (1000 mL’ye tamamlanıp 16 saat IV).
Erişkinden farkli olarak antidotun, kan parasetamol düzeyi olmadan başlanma endikasyonu yoktur. Kan düzeyine ilaç alımdan sonraki ilk 8 saat içinde ulaşmak gerekir.
10. Panzehir olarak sodyum bikarbonat kullanımı
Çeşitli toksidromlarda sodyum bikarbonat infüzyonu zehirlenme için endikedir. EKG’ de geniş bir QRS ile presente olan Trisiklik antidepresan (TCA) zehirlenmesi, salisilat zehirlenmesi veya kokain zehirlenmelerinde kullanımı endikedir. TCA ve kokainle ilişkili kardiyak toksisite için doz genellikle 1-2 mmol/kg %8,4 sodyum bikarbonat intravenöz olarak infüze edilir. İdrar pH’ sı 7,5 ile 8,0 arasında tutulmaya hedeflenir. Salisilat zehirlenmesi için spesifik bir panzehir yoktur ve salisilat doz aşımının ilk tedavisi,
yeterli bir hava yolu ve yeterli sirkülasyon, ardından aktif kömür verilerek gastrik dekontaminasyondur. İntravenöz yolla idrar ve plazmanın alkalileştirilmesi bolus sodyum bikarbonat ve ardından sodyum bikarbonat infüzyonu eliminasyonu artırmak için etkili bir yöntemdir. Salisilat seviyesi 35 mg/dL’den fazla olan ve alımdan sonra 6 saat geçmiş olanlara serum pH’ından bağımsız olarak sodyum bikarbonat tedavisi önerilir. Kokain zehirlenmelerinde sempatomimetik toksikromlar arasında midriyazis, hipertermi,
piloereksiyon, terleme, ajitasyon, anksiyete, sanrı ve paranoya beklenir. Kardiyak toksisite hipertansiyon, taşikardi, aritmiler ve miyokard enfarktüsüne neden olur. Çocukta daha çok fatal disritmiler ve nöbetler ile başvuru görmekteyiz. Başlangıç tedavisinde elektrolit anormalliklerinin stabilizasyonu ve düzeltilmesi ve sonrasında sodyum bikarbonat infüzyonu ve lidokain etkili olacak ilaçlardır.
Çocukluk çağında antidotların kullanımları hakkında multidisipliner karar verilmelidir. Öykü ve fizik muayene ile ön tanı oluşsa da özellikle çocukluk dönemi zehirlenmelerinde laboratuar analizleri tedavi indikasyonlarını belirlemede erişkinden daha önemlidir. Tüm Acil Tıp hekimlerinin multidisipliner yaklaşımla güncel kılavuzlara uygun tedavi protokollerini uygulaması gerekmektedir.
1. Hon KL, Hui WF, Leung AKC. Antidotes for childhood toxidromes. Drugs in Context 2021; 10: 2020-11-4. DOI: 10.7573/dic.2020-11-4
2. Peden M, Oyegbite K, Ozanne-Smith J, et al., eds. World Report on Child Injury Prevention. Geneva: World Health Organization World Health Organization, Unicef; 2008:31–56. http://www.who.int/violence_injury_prevention/child/injury/world_report/ World_report.pdf. Accessed April 22, 2021.
3. Koren G. A primer of paediatric toxic syndromes or “toxidromes.” Paediatr Child Health. 2007;12(6):457–459. https://doi.org/10.1093/pch/12.6.457a
Giriş
Tüm ılıman iklimi olan ülkeler gibi ülkemizde de mantarların yaşamaya en elverişli dönemi olan bahar ayları mantar zehirlenmeleriyle en sık karşılaştığımız dönemlerdir. Bazılarımız için çok lezzetli olsa da doğa yürüyüşlerinde, doğa kamplarında sıkça ‘Acaba zehirli mi?’ sorusunu aklımıza getiren doğadan toplanan yabani mantarlar çok tehlikeli olabilmektedir. Klinik pratikte sıklıkla yirmi yıldır aynı bölgeden mantar toplayıp tükettiğini ve şimdiye kadar hiçbir şey olmadığını, şu anki şikayetlerinin başka bir nedenden dolayı olduğunu iddia eden ancak mantar zehirlenmesi olan hastalarla karşılaşırız. Ölümcül mantar zehirlenmelerinin %90’ını oluşturan Amanita phalloides fenotipi ile sıkça tüketilen zehirsiz bir tür olan Agaricus bisporus fenotipinin neredeyse aynı olduğu, şekil ve renk olarak birbirine çok benzeyen zehirli ve zehirsiz türlerin kolayca karıştırılabileceği düşünüldüğünde, yabani mantarların böyle cesurca tüketilmemesi doğru bir yaklaşım olacaktır. Bu yazıda ülkemizde de sıkça karşılaştığımız Amanita phalloides mantarının zehirlenmesinden bahsedeceğiz.
Klinik süreç
Zehirlenme, mantar tüketimini takip eden birkaç saat boyunca asemptomatik enkübasyon, ardından mide bulantısı, kusma, karın ağrısı, diyare ve hatta şiddetli dehidratasyona dek olmak üzere ciddi gastrointestinal semptomlar ve sonunda çoklu organ işlev bozuklukları ile karakterize bir süreçtir. İlk iki saat içinde ortaya çıkan semptomlar erken, altı saat ve üzerinde ortaya çıkan semptomlar geç başlangıçlı olarak sınıflandırılır. Geç başlangıçlı bulguları olan zehirlenmeler daha mortal seyretmektedir. Amanita phalloides zehirlenmesinin erken teşhisi çok önemli olmakla beraber, atipik başlangıç semptomları nedeniyle sıklıkla gastroenterit ve besin zahirlenmei ile karıştırıldığı için zordur. Amanita phalloides zehirlenmesinde esas etkilenen organ karaciğerdir. Aminotransferaz enzimlerinde ve bilirubinlerde ani bir yükselme ile karakterize akut karaciğer yetmezliği amatoksin zehirlenmesinin ana patofizyolojik özelliğidir. Karaciğerle beraber böbrekler ve merkezi sinir sistemi de etkilenir. Amanita phalloides zehirlenmesinin genel şiddeti, alınan toksinin miktarına ve zehirlenme anı ile tedavinin başlaması arasında geçen süreye bağlıdır.
Patofizyoloji
Amanita phalloides zehirlenmesinin mekanizması çok karmaşıktır. Klasik mekanizma, amatoksinlerin çekirdekte RNA polimeraz II (RNAP II) aktivitesini nonkovalent şekilde bağlayarak inhibe etmesidir. Ayrıca, Rpb1 alt biriminin bozulmasına yol açan bu bağlanma, onun geri dönüşümsüz inhibisyonuna ve protein sentezinin azalmasına neden olur. Ek olarak, a-amanitin ile etkilenen karaciğer hasarında, p53 ve kaspaz-3-bağımlı apopitoz yer alır. Amanita phalloides’ten izole edilen toksophallin toksininin, oksidatif stres ile ilişkili bir L-amino asit oksidaz olduğu tespit edildi. Masif nekroza katkıda bulunan oksidatif stres, ciddi hepatotoksisite gelişiminde önemli bir rol oynar.
Amanita Phalloides Zehirlenmesinin Yönetiminde Güncel Yaklaşımlar
Amanita phalloides zehirlenmesinde tedavinin temel amacı, destekleyici tedavi kullanarak yaşamsal fonksiyonların stabilizasyonunu sağlamaktır. Daha sonra diğer terapötik yöntemler uygulanabilir. Amatoksin zehirlenmesinin genel yönetimi, esas olarak amatoksin emiliminin önlenmesini, emilen amatoksinlerin ortadan kaldırılmasını, karaciğer hasarına karşı potansiyel antidot tedavisini ve karaciğer naklini içerir.
Amatoksin emiliminin önlenmesi
Amanita phalloides ağızdan alındığında, amatoksinler gastrointestinal sistemde hızla emilir. Bu nedenle, amatoksinlerin gastrointestinal sistemden emilimini etkili bir şekilde azaltmak için hemen gastrik lavaj ve aktif kömür kullanılır. Gastrik lavaj, midede kalan toksik maddeleri azaltır ve etkinliği oral alımından acil servis başvurusuna kadar geçen süreye bağlıdır. İlk 1 saat en etkili dönemi olup şiddetle tavsiye ediliyor ancak mantar alımı ile semptomların başlaması arasındaki asemptomatik gecikme fazı nedeniyle, hastaların hastaneye başvurması genellikle ciddi gastrointestinal bozukluklar ortaya çıktıktan sonraki zamana denk gelir. Bu nedenle, gastrik lavajın etkinliği büyük ölçüde azalır. Diğer bir deyişle, tüm hastalar gastrik lavajdan fayda görmeyebilir. Yine aktif kömür de gastrik lavaj gibi şiddetle tavsiye ediliyor. Aktif kömürün etkinliği çoğunlukla alım ile tedavi arasında geçen süreye bağlı olsa da toksin emilimini potansiyel olarak azaltmakla kalmayıp amatoksinlerin enterohepatik dolaşımını da kesebildiği için rutin olarak uygulanabilir. Önerilen aktif kömür dozu her 4 saatte bir 50 g veya 2 saatte bir 25 g idi. Eğer kusma eşlik ediyorsa, doz saatte 12.5 g’a düşürülebilir.
Absorbe edilen amatoksinlerin ortadan kaldırılması
Amatoksinlerin yaklaşık %60’ı safraya atılır ve enterohepatik dolaşıma geçer ve yaklaşık %40’ı da böbrekler tarafından temizlenir. Amatoksinler toksikokinetiği nedeniyle doğrudan hepatotoksisiteye ve nefrotoksisiteye neden olur. Bu nedenle, intravenöz hidrasyon, diürez, safra drenajı ve ekstrakorporeal eliminasyonu içeren tedavi yöntemleri, toksik etkileri hafifletmeyi amaçlayarak amatoksinlerin eliminasyonunu desteklemek için kullanılabilir.
Bulantı, kusma ve diyare gibi erken gastrointestinal belirtiler nedeniyle, Amanita phalloides zehirlenmesi olan hastaların çoğunda dehidratasyon mevcuttur. Daha da önemlisi, şiddetli dehidratasyon hızla laktik asit artışına ve akut böbrek hasarına (ABH) yol açan renal kan akışının azalmasına neden olur. Zayıf doku perfüzyonu sonunda çoklu organ yetmezliğine neden olur. Bu nedenle, yeterli intravenöz hidrasyon, metabolik asidozu iyileştirmek ve elektrolit anormalliklerini düzeltmek için temel bir terapötik yaklaşımdır. Yeterli böbrek fonksiyonunu sürdürmek ve geri dönüşümsüz karaciğer hasarını azaltmak için erken agresif sıvı resüsitasyonu çok önemlidir.
Amatoksinler, zehirlenmeden sonraki dördüncü güne kadar idrarda hala saptanabilmektedir. Diürez, amatoksinlerin renal klirensini artırmak için yararlı bir etki göstermiştir. Bununla birlikte 4-5 gün boyunca 100-200 mL/saat’lik idrar çıkışını sağlamak amatoksinlerin renal eliminasyonunu arttırmak için yeterli olacaktır.
Enterohepatik dolaşımın perkütan safra drenajı ile kesilmesi amatoksin emilimini azaltabilir. Yapılan deneylerde biliyer fistül ameliyatı geçiren köpeklerin ölümcül dozda amatoksin enjekte edildikten sonra hayatta kaldıklarını bildirilmiştir. Benzer şekilde başka çalışmalarda nazobilier drenaj ve endoskopik biliyer diversiyon Amanita phalloides zehirlenmesi olan hastalarda tatmin edici bir terapötik etki göstermiştir.
2.2.4. Ekstrakorporeal eliminasyon
Plazmaferez, Amanita phalloides zehirlenmesi için etkili bir tedavi yaklaşımı olarak kabul edilmektedir. Genel olarak, destekleyici tedavi ile birlikte plazmaferez sadece amatoksinleri ve metabolik artıklarını kandan uzaklaştırmakla kalmaz, aynı zamanda hepatosit rejenerasyonu için iç ortamı korumak üzere albümin, immünoglobülinler, pıhtılaşma faktörleri, fibrinolitik proteinler ve mineral tuzları sağlar.
Hemodiyaliz ve hemoperfüzyon daha önceleri Amanita phalloides ile zehirlenen hastalarda önerilmiştir. Fakat daha sonra yapılan daha geniş çalışmalar, toksinlerin plazmada yalnızca çok erken dönemde saptanıp çok kısa bir süre bulunmasından dolayı, bu tedavi yöntemlerinin etkilerinin ihmal edilebilir düzeyde olduğunu göstermiştir.
Moleküler adsorban resirkülasyon sistemi (MARS), karaciğerin iyileşmesini sağlamak için akut zehirlenmenin neden olduğu karaciğer yetmezliğinin tedavisinde uygulanan yapay bir karaciğer destek sistemidir. Karaciğerin detoksifikasyon fonksiyonunu kısmen kompanse etmek için proteine bağlı maddeleri ve suda çözünen toksinleri kandan uzaklaştır. Standart destekleyici tedavi ve MARS tedavisi alan hastaların hiçbir ciddi komplikasyon olmaksızın hayatta kaldığını bildiren yayınlar mevcuttur. Ek olarak geçici iyi sonuçları olan MARS, Amanita phalloides intoksikasyonunda karaciğer transplantasyonu için bir köprü olarak kabul edilmiştir. MARS toksinleri uzaklaştırabilse de plazmaferez ile karşılaştırıldığında, alanin aminotransferaz (ALT), aspartat aminotransferaz (AST) ve total bilirubinde daha az iyileşme sağladığı raporlandı. Bu nedenle, MARS ile plazmaferez kombinasyonunun, amatoksin zehirlenmesi hastalarının tedavisinde her iki yöntemden daha etkili olabileceği düşünülmektedir ancak bu kanıyı destekleyecek yeterli çalışma bulunmamaktadır.
Fraksiyone plazma ayırma ve absorpsiyon (FPSA), akut karaciğer yetmezliği olan hastalarda, albümine bağlı olan ve suda çözünen endojen toksinleri detoksifiye eden bir başka etkili ekstrakorporeal karaciğer destek sistemidir. MARS ile karşılaştırıldığında, FPSA önemli ölçüde daha yüksek bilirubin, amonyak ve üre temizleme oranları elde edebilir. Ayrıca FPSA, MARS tarafından temizlenemeyen konjuge olmayan bilirubini de uzaklaştırabilir. Ne yazık ki, randomize kontrollü çalışmalar hala eksik olduğundan, FPSA’nın tercih edilip edilmeyeceği sorusuna cevap vermek zordur.
Potansiyel antidotlarla tedavi
Amanita phalloides zehirlenmesinin tedavisinde, amatoksinlerin eliminasyonunu artırmaya yönelik ekstrakorporeal tedavi yöntemlerinin yanı sıra, benzilpenisilin, N-asetilsistein ve silibinin (ya da silimarin) gibi bir dereceye kadar başarı gösteren potansiyel “spesifik” antidotlar da mevcuttur. Bunlardan benzilpenisilin, silimarin ve silibinin amatoksinin karaciğer hücresince alımını inhibe ederken, C vitamini, simetidin ve N-asetilsistein amatoksinin yaptığı lipid peroksidasyonunu dolayısıyla hücre zarı instabilitesi ve hücre ölümünü durduran antioksidanlardır.
Silibinin iv-(ya da silimarin oral) süt devedikeni Silybum marianum’un tohum ve meyvelerinden elde edilen standardize edilmiş bir ekstraktır. Silibinin, her viali 350 mg silibinine eşit silibinin dihemisuccinate içeren Legalon SIL adı ile bulunmaktadır. Hepatosit büyümesini ve rejenerasyonunu teşvik ederek ve hepatik oksidasyon ve inflamasyonu inhibe ederek hepatoprotektif etkiler göstermektedir. Belgelenmiş yaklaşık 1500 vakada, intravenöz silibininle tedavi edilen hastalardaki genel ölüm oranı, silibininle birlikte veya silibininsiz (%N20) penisilinle tedavi edilen hastalardakine kıyasla <%10 olmuştur Silibinin, amatoksinlerin hepatositlere alınmasını engelleyebilir ve enterohepatik dolaşımı kesintiye uğratarak amatoksinlerin hücre içi konsantrasyonlarını ve toksik etkilerini azaltıyor olabilir. Silibininin, özellikle alımdan sonraki ilk 24 saate başlandığında, insan hepatositleri üzerindeki a-amanitin kaynaklı toksisiteye karşı güçlü bir koruyucu etki gösterdiği gösterilmiştir. Silibinin CIAV ve Yeni Zelanda Ulusal Zehir Merkezince, hayvan çalışmaları ve kısıtlı insan verilerine dayanılarak, 5 mg/kg yükleme dozunda bir saatte verildikten sonra 20-50 mg/kg/gün dozunda intravenöz olarak uygulanması ve 48-96 saat devam etmesi önerilir. Ayrıca, zehirlenen hastalara intravenöz olarak 5 mg/kg yükleme dozunda bir saatte verilip, altı gün ya da karaciğer fonksiyonu ve INR normale dönene kadar günde 20 mg/kg sürekli dozda verilmesi de önerilmektedir. Silimarin kapsülleri %50 silibinin içerir ve oral absorbsiyonu %20-40 ve yarı ömrü 6 saat olan silimarin, alımla etkin plazma konsantrasyonuna 3-5 saatte ulaşır. Ancak 10 gr/gün silimarin kapsül alınarak 20 mg/kg/gün silibinin yarattığı etkiye eşdeğer ulaşılabilir. Yüksek dozlar ciddi diyare yapar ve hasta yönetimini negatif etkiler. Bu nedenle 8 saatte bir 50-100 mg/kg dozlar (maksimum tek doz 2 gr) ile başlanıp tolere eden hastada 200 mg/kg’a dek (maksimum tek doz 3 gr) çıkılır. Yine 6 gün ya da klinik düzelme olana dek devam edilir. Tolere edemeyen hastalarda başlangıç deneme dozu düşülebilir ancak etki yetersiz olacaktır. Bu nedenle ondansteron ile birlikte (0,15 mg/kg-maksimum 16 mg) ve diyare geliştiğinde etkin sıvı elektrolit desteği ile gidilmelidir. Sağlık takviyesi olarak karaciğer toniği adıyla satılan sıvı dilüe formları, çok düşük silibinin içerdiği ve tedavi edici olmadığı için amatoksin zehirlenmeli hastalara önerilmemektedir.
Aslında Benzilpenisilin, Amanita phalloides zehirlenmesinin tedavisinde en yaygın kullanılan ilaçlardan biridir. Önceki bulgular, benzilpenisilinin, hepatositlerde a-amanitin alımını bloke etmek için plazma zarında yer alan Organik Anyon Taşıyan Polipeptit 1B3 (OATP1B3) taşıyıcısını potansiyel olarak inhibe ettiğini göstermiştir. Benzilpenisilinin, amatoksinlere maruz kalan hepatositlerin canlılığını önemli ölçüde arttırdığı ve apoptoz belirteçlerinin (kaspaz-3, annexin V ve p53) ekspresyonunu azalttığı gösterilmiştir. Silimarin ile birlikte Benzilpenisilinin, Amanita phalloides ile zehirlenmiş köpeklerde plazma aminotransferazların (ALT ve AST) ve alkalin fosfatazın (ALP) yükselmesini inhibe ettiği gösterilmiştir. Yapılan çalışmalarda destekleyici önlemlerle birlikte benzilpenisilinin zehirlenmenin tedavisinde etkili olduğunu göstermiştir. Özellikle silimarin bulunamadığında sürekli infüzyon halinde yüksek dozda önerilen 300.000-1 milyon U/kg/gün (maksimum 40 milyon U/gün) iv infüzyon önerilmektedir. Benzilpenisilin dozları sırasıyla CIAV ve TOXBASE tarafından ise 1 MU/kg/gün ve 0,5 MU/kg/gün olarak öneriliyor. Ancak benzilpenisilin, güvenlik ve allerji potansiyeli nedeniyle Yeni Zelanda Ulusal Zehirler Merkezi tarafından önerilmemektedir. Ayrıca silimarin ile birlikte verilmesinin silimarinin tek başına verilmesine üstünlüğü olmadığı da bildirilmiştir. Tedavide glutatyon veya N-asetilsistein ile birlikteliği daha düşük mortalite ile sonuçlanmıştır.
N-asetilsistein, asetaminofen zehirlenmesinin yanı sıra on yıllardır amatoksin zehirlenmesinin tedavisinde uygulanmaktadır. N-asetilsistein, yalnızca serbest radikallerin “çöpçü” indirgeyici maddesi olarak değil, aynı zamanda endojen depolar tükendiğinde bir glutatyon öncüsü olarak işlev görür. Ek olarak, N-asetilsistein, amatoksinlerin toksisitesi için gerekli olduğu bilinen molekül içi triptatiyonin köprüsünü değiştirerek toksinin yapısını bozar. Amatoksin zehirlenmesi olan hastalara standart tedavi kombinasyonunda N-asetilsistein verilen önceki retrospektif çalışmalarda, yaklaşık %90 genel sağkalım gösterilmiştir. N-asetilsistein ile, insan hepatositlerinde a-amanitin kaynaklı apoptoz üzerinde de koruyucu bir etki gösterilmişken köpek hepatositlerinde bu etki görülmemiştir. Tesadüfen, tek başına N-asetilsistein ile tedavi farelerde fayda sağlamazken, yüksek mortaliteye neden olduğu bildirilen yayın mevcuttur. Bu yüzden monoterapi N-asetilsistein önerilmektedir. CIAV tarafından muhtemelen anafilaktoid reaksiyon insidansı ve Amanita phalloides hastalarında klinik sonucun bir göstergesi olan International Normalized Ratio (INR)’yi yükseltmesi nedeniyle N-asetilsistein önerilmemektedir. Bununla birlikte, Yeni Zelanda Ulusal Zehir Merkezi tarafından 15 dakikada intravenöz olarak 150 mg/kg, ardından 4 saatte 50 mg/kg ve ardından 16 saatte 100 mg/kg dozunda (ki bu 20-21 saat içinde 300 mg/kg demek) önerilmektedir.
Simetidin ve C-vitamini antioksidan ve sitoprotektif özelliklidirler. Özellikle hayvan çalışmalarında faydası gösterilse de insan çalışmalarında net sonuçları olmayan, ancak ciddi yan etkileri de olmadığından kullanılabilecek bu tedavilerden, simetidin her 8 saatte bir 300 mg/kg iv, C-vitamini 3 gr/gün iv olarak, silibinin ve N-asetilsisteine ek olarak ve klinik iyileşme sağlanana dek önerilmektedir.
Deneysel tedaviler
Çeşitli polisakkaritler, peptidopolisakkaritler, amino asitler, terpenler ve steroidler içeren geleneksel bir Çin tıbbı olan Glossy ganoderma decoction (GGD) insan vücudu üzerinde modülatör etkiler gösterebilir. GGD, hepatositleri karbon tetrakloridin (CCl4) neden olduğu hücresel hasardan koruyabilir ve apoptozu inhibe ederek hepatoprotektif etkiler gösterebilir. Ganoderma lucidum’dan elde edilen triterpenoidlerin, farelerde a-amanitin tarafından indüklenen karaciğer hasarı üzerinde radikal süpürme aktivitelerini artırarak ve apoptozu inhibe ederek hepatoprotektif etkiler gösterdiği de gösterilmiştir. Akut Amanita phalloides zehirlenmesi olan 12 hastada günlük olarak GGD ile tedavi edildikten sonra, kontrol grubuna (11 hasta) kıyasla mortalitenin büyük ölçüde azaldığı raporlanmıştır. Ancak bu konuda yapılan çalışmalar da yetersiz olduğu için GGD’nin etkili bir ilaç olduğunu düşünmek fala iyimser bir yaklaşım olacaktır.
Polymyxin B, Amanita phalloides zehirlenmesinde bir atılım olarak kabul edildi. Polimiksin B, a-amanitin ile aynı arayüzde potansiyel olarak RNAP II’ye bağlanabilir ve toksinin RNAP II’ye bağlanmasını önleyebilir. Bir in vivo çalışmada, polimiksin B, a-amanitin kaynaklı hepatik ve renal hasarı önemli ölçüde azaltmıştır. Ayrıca, polimiksin B uygulaması, a-amanitin ile tedavi edilen hayvanlarda hayatta kalma oranını önemli ölçüde artırmıştır. Polimiksin B’nin insanlarda Amanita phalloides zehirlenmesi için yeni bir farmakolojik yaklaşım olarak uygulanabileceği beklenmektedir.
Metil grup transferleri, transsülfürasyon ve aminopropilasyonda yer alan S-Adenosil-L-metiyonin olarak da adlandırılan Transmetil çeşitli karaciğer hastalıklarının tedavisinde kullanılmaktadır. Akut Amanita phalloides zehirlenmesi olan altı hastaya geleneksel protokolle kombine Transmetil uygulanan bir çalışma, transmetilin geleneksel protokolle tedavi edilen kontrol grubuna kıyasla mortaliteyi azaltabileceğini göstermiştir. Başka çalışmalarda, resveratrolün karaciğerde mononükleer hücre infiltrasyonunu, nekrozu ve aktif kaspaz-3 immünopozitivitesini azalttığı ve antiinflamatuar özellikleri ile α-amanitin kaynaklı hepatotoksisitede etkili olabileceği, dahası antioksidan olarak özellikle nefrotoksisiteden koruyabileceği bildirilmiştir. Siklosporin-A, paklitaksel ve rifampin hepatositlere amatoksin alımını inhibe eder. Tüm bunlar deneysel aşamada hayvanlar ve insan hücre kültürlerinde etkin diğer ajanlar olup bu ilaçlarla ilgili yapılan insan çalışmaları yeterli değildir.
Karaciğer Nakli
Amanita phalloides ile zehirlenen hastalar etkili bir şekilde tedavi edilmezse, bazı vakalarda ani ve ciddi karaciğer fonksiyon bozukluğu ile karakterize akut karaciğer yetmezliği gelişebilir. Sonuç olarak, hastaların hayatta kalmasını sağlamak için acil karaciğer nakline ihtiyaç duyulur. Karaciğer transplantasyonunun zamanlamasına karar vermek için Clichy kriterleri, Escudie kriterleri, Ganzert kriterleri ve King’s College kriterleri gibi çeşitli kriterler kullanılmaktadır. Bunların arasında King’s College kriterleri, karaciğer transplantasyonu için en yaygın kullanılan kriterler olmuştur. Asetaminofenin neden olmadığı fulminan karaciğer yetmezliği için King’s College kriterleri şunları içerir: protrombin zamanı>100s; yaş<10 veya yaş>40, ensefalopati başlangıcından önce 7 günden uzun süren sarılık, protrombin zamanı>50 s ve bilirubin >300 μmol/L [66]. Ancak, amatoksinlerin neden olduğu akut karaciğer yetmezliği için King’s College kriterlerinin uygulanması sınırlıdır. Escudie’nin kriterleri, mantar alımı ile ishal başlangıcı arasında 8 saatten az bir süre geçen hastalarda karaciğer transplantasyonunun yapılmasını şiddetle tavsiye etmektedir. Ayrıca, >4 gün INR >6 veya protrombin indeksinin normalin %10’unun altına düşmesi halinde karaciğer nakli düşünülmelidir. Maurizio Bonacini ve ark. tarafından bildirilen yakın tarihli bir araştırmaya göre, 4000 IU/L’den yüksek aspartat aminotransferaz (AST) seviyeleri karaciğer nakil merkezlerine sevk edilmelidir. Son olarak, Amanita phalloides ile zehirlenmiş hastalarda karaciğer transplantasyonu için altın kriter yoktur, ancak karaciğer transplantasyonunun kötü prognozlu hastalarda hayatta kalmaya faydaları bilinen tek yöntemdir.
Özet
Amanita phalloides zehirlenmesinin standart bir tedavi protokolü yoktur. Amatoksin zehirlenmesininin tedavisinde esas, destekleyici önlemler kullanılarak hayati fonksiyonların stabilizasyonu, karaciğer hasarlanmasının durdurulması, karaciğer rejenerasyonunun sağlanması ve eğer fulminan hepatik yetmezlik tablosu gelişiyorsa karaciğer transplantasyonu için zamanında harekete geçmektir.
Sırasıyla;
KAYNAKLAR
Temel toksikoloji kursumuz 26 Mayıs 2023 günü Bursa’da Bursa Şehir Hastanesi Acil Tıp Kliniği Seminer salonunda gerçekleşecektir.
Kayıtlar tatdem üzerinden online olarak gerçekleştirilecektir.
Katılım için kayıt linkimiz: https://tatd.org.tr/tatdem/kurs/26-mayis-2023-bursa/
Çalışma Grubu Başkanı: Prof. Dr. Ayça Açıkalın AKPINAR
Kurs Koordinatörü: Prof. Dr. Ataman KÖSE
Yerel Organizasyon: Prof. Dr. Mehtap Bulut
Diğer Eğitmenler:
| Prof. Dr. Ataman KÖSE Prof. Dr. Mehtap Bulut Prof. Dr. Özlem Köksal |
| Doç. Dr. Sinan Karacabey Doç. Dr. Suna Eraybar Doç. Dr. Aslıhan Durak |
| Uzm. Dr. Emre Kudu |
Kursun Amacı, Kapsamı ve Hedefleri
TATD Toksikoloji Kurslarının amacı tüm acil tıpta uzmanlık öğrencileri, acil tıp uzmanları ve 2. basamakta görev yapan hekimlere toksikoloji hastalarının yönetimi hakkında bilgi vermektir. Hem tanısal hem de tedaviye yönelik kılavuzlar geliştirilme yöntemleri de kurslarda gösterilmektedir.
Kursun Hedef Kitlesi
Acil Tıp Asistanları (tüm kıdemler), Acil Tıp Uzmanları, 2. basamakta görev yapan hekimler
Kurs Planı
Kurs bir gün olarak tasarlanmış olup sabah 08:30’da kayıt ile başlayacaktır. ilk ders saat 09:00’da olup; 16:40’da bitecek şekilde planlanmıştır.
Katılımcı sayısı ve Oturma Düzeni
Katılımcı sayısı 30’tür. Bu kursun oturma düzeni sınıf düzenidir.
Kursa nasıl kayıt yaptırırım?
Kurs fiyatı ve dahil olanlar: Kurs ücreti: TATD üyesi için 650 TL, TATD üyesi olmayanlar için 750 TL.
Kurs konuları ve Programı
| Toksikolojide Semptomatoloji ve Toksidromlar |
| Dekontaminasyon ve Antidot Tedavileri |
| İnhalasyon Ajanları ile Zehirlenmeler (Karbonmonoksit Zehirlenmeleri, Siyanür) |
| Beta Bloker /Kalsiyum Kanal Blokeri zehirlenmeleri |
| Antidepresan Zehirlenmeleri |
| Venomu olan hayvanlara bağlı zehirlenmeler: Yılan, Akrep sokmaları Parasetamol Zehirlenmeleri |
| Alkol Zehirlenmeleri |
İletişim ve ulaşım için adres, telefon, e-posta ve haritalar
Adres: T.C. Sağlık Bakanlığı Bursa Şehir Hastanesi Acil Tıp Kliniği Seminer salonu/ Doğanköy Mahallesi, 16110 Nilüfer / BURSA
İletişim: Prof. Dr. Mehtap Bulut
05057163655
Prof. Dr. Ataman KÖSE
05327750512
Doç. Dr. Suna Eraybar
05325782903
Kurs Koordinatörü: Prof. Dr. Ataman KÖSE
Tarih ve Yer: 26 Mayıs 2023 Bursa Şehir Hastanesi Acil Tıp Kliniği Seminer salonu
| KONU | EĞİTMEN | |
| 08:30-09:00 | Kayıt | |
| 09:00-09:40 | Toksikolojide Semptomatoloji ve Toksidromlar | Prof. Dr. Mehtap Bulut |
| 09:40-10:20 | Dekontaminasyon ve Antidot Tedavileri | Doç. Dr. Suna Eraybar |
| 10:20-10:40 | ARA | |
| 10:40-11:20 | İnhalasyon Ajanları ile Zehirlenmeler (Karbonmonoksit Zehirlenmeleri, Siyanür) | Doç. Dr. Aslıhan Durak |
| 11:20-12:00 | Venomu olan hayvanlara bağlı zehirlenmeler: Yılan, Akrep sokmaları | Prof. Dr. Ataman Köse |
| 12:00-13:30 | ÖĞLE YEMEĞI | |
| 13:30-14:10 | Beta Bloker /Kalsiyum Kanal Blokeri zehirlenmeleri | Prof. Dr. Özlem Köksal |
| 14:10-14:50 | Alkol Zehirlenmeleri | Doç. Dr. Sinan Karacabey |
| 14:50-15:10 | ARA | |
| 15:10-15:50 | Antidepresan Zehirlenmeleri | Doç. Dr. Suna Eraybar |
| 15:50-16:10 | Parasetamol Zehirlenmeleri | Uzm. Dr. Emre Kudu |
Bölüm 1 – Giriş ve Radyasyon Hakkında Temel Bilgiler
Radyasyona maruziyet (irridasyon) kişinin radyoaktif maddenin bulunduğu ortamda bulunmasıyla oluşur ve kontaminasyondan farkı irridasyon durumunda herhangi bir radyoaktif madde geçişi gözlenmez ve çevresine tehlike oluşturmaz. Kişinin eksternal ya da internal olarak vücudunda radyoaktif madde bulundurması ise kontaminasyon olarak tanımlanır ve bu durumda radyoaktif maddenin etrafa yayılımı gözlenir ve çevresi için tehlikeli durum arz edebilir. Eksternal kontaminasyon radyasyonun kaynaktan cilde ve hatta daha derine ulaşması ile oluşur, internal kontaminasyon ise radyoaktif partiküllerin yutulması veya solunması ile oluşur.
Radyoaktiviteden korunmak için dört faktör önemlidir. Zaman, mesafe, koruyucu ekipman ve radyoaktif maddenin miktarı. Kişi radyasyondan etkilenimini azaltmak için kaynağa olan mesafesini arttırmalı, ortamı dekontamine etmeye çalışmalı, kaynakla aynı ortamda bulunma süresini azaltmalı ve kaynakla arasına koruyucu koymalıdır. Mevcut tıbbi tedavi orta ve yüksek dozda maruziyetlerde hayati öneme sahiptir.
Radyolojik partiküllerle kontamine olmuş hastalar genellikle, eğer koruyucu ekipman kullanımına ve dekontaminasyon kurallarına uyulmuşsa, sağlık personeline önemli bir akut radyasyon dozuna maruziyet için tehlike oluşturmaz. Bu sebeple sağlık personeli, iyonlaştırıcı radyasyon ya da radyoaktif kontaminasyonla oluşan konvansiyonel travmaları tedavi etmekten kaçınmamalıdır. Sağlık personeli kontaminasyon açısından takip edilmeli ve tedavi sonrasında gerekliyse eğer dekontamine edilmelidir. Sadece ışına maruz kalmış, kontamine olmamış hasta sağlık personeline herhangi bir risk oluşturmaz.
Kontamine bir hastaya müdahale ederken, öncelikle sağlık personelinin ve diğer personelin güvenliği sağlanmalıdır. Kontamine alana girerken koruyucu kıyafet ve ekipman kullanılması, alanın dekontamine edilmesi, gereksiz eşyaların ortamdan atılması, giriş ve çıkışların kontrolü, negatif basınç kullanılması, kontamine alanda çalışacak personel sayısının ve içeride kalınan sürenin minimuma indirilmesi gibi önemler alınması elzemdir. Bütün önlemlere rağmen bazı kontamine alanlardaki dekontaminasyon çalışmalarında ve diğer müdahalelerde alanda çalışan personelin kontaminasyonunun önüne geçilemeyebilir.
Radyasyon kazaları küçük ve büyük ölçekli olarak ikiye ayrılır. Küçük ölçekli kazalar bir veya birkaç kişininin irridasyon veya kontaminasyona maruz kaldığı düşük miktarlarda radyoaktif madde salınan, laboratuvarlar, hastane ve nükleer enerji santrallerinde görülen kazalardır. Büyük ölçekli kazalar ise, fazla miktarda radyoaktif madde salınan, çok sayıda insanın irridasyon ve kontaminasyona maruz kaldığı kazalardır. Bu tip kazalara örnek olarak radyolojik silahlarla yapılan terör saldırıları ve nükleer santral kazaları örnek gösterilebilir.
Kazalar haricinde nükleer endüstrideki radyoaktif maddelerin depolanması, taşınması, rutin işlevlerinde kullanılması gibi bazı iş gruplarında çalışan kişilerde de radyasyona maruziyet ve kontaminasyon görülebilir.
1.2. Radyasyon Türleri
Birinci derecede öneme sahip beş radyasyon türü:
• Alfa (α) parçacıkları: Pu ve U gibi ağır çekirdeklerden yayılan parçacıklardır. İki proton ve iki nötrondan oluşurlar. Havada yaklaşık 1 inçten fazla gidemez ve derinin ölü tabakasından öteye geçemez. İnce kıyafetler alfa parçacıklarına karşı koruyucudur fakat internal kontaminasyonda daha fazla hasar oluştururlar.
• Beta (β) parçacıkları: Alfa parçacıklarına göre dokuda daha derine (birkaç mm, epidermisin bazal tabakasının derinlerine kadar) giderler, havada birkaç metre gidebilirler. trityum ve 90Sr gibi izotopların çekirdeklerinden yayılan elektronlardır. Plastik yüz maskeleri gibi ince plastik tabakalar Beta parçacıklarından koruyabilir. Beta parçacıklar internal kontaminasyonda önemli bir tehlikedir.
• Gama (γ) ışınları: Çekirdekten çıkan, UV’den daha kısa dalga boylu, iyonizasyon yaratan elektromanyetik radyasyondur. Yüksek penetrasyon gücü sebebiyle iç organlara kadar ulaşır. Eksternal kontaminasyonu oldukça tehlikelidir. Kurşun bloklar gibi yoğun maddeler gama ışınlarının geçişini engeller.
• X-ışınları: gama ışınlarının aksine çekirdeğin dışından çıkar, gama ışınlarından sadece çıkış noktaları bakımından farklıdır.
• Nötronlar: yüksüz parçacıklardır fakat herhangi bir maddeyi radyoaktif hale getiren tek türdür. Gama ışınlarına göre daha fazla ileriye dönük etki gösterir. Fizyon işlemi sırasında ve bazı tahribatsız test prosedürlerinde etrafa yayıldıkları için önemlidirler.
1.3.Birimler
ABD’de kullanılan temel radyoaktivite birimi curie’dir (Ci) ve 3.7 x 1010 bekerel (Bq) olarak tanımlanır. Saniyede bir parçalanma anlamına gelen bekerel, temel SI birimidir (Fransızca le Système International d’unités). Bir Ci 37 gigabekerel (GBq) ve bir GBq 27 milicurie’ye (mCi) eşittir.
Aktivite, mevcut radyoaktif madde miktarını ölçmek için kullanılan kavramdır. Emilen radyasyon miktarı, iyonlaştırıcı radyasyon tarafından dokuda biriktirilen enerjinin ölçümünde kullanılır. ABD’de bu birim rad’dır. Bir rad, bir gram dokuda biriken 100 ergs (10-7 joule) enerjiye eşittir. Emilen radyasyon miktarı için SI birimi gray’dir (Gy) ve bir kilogram dokuda biriken bir joule enerjiye eşittir. Akut tıbbi etkilere ilişkin kullanılacak en uygun birimin rad veya Gy olduğu yaygın bir şekilde kabul edilmektedir.
1 Gy = 100 rad 1santigray (cGy) = 1 rad
Kalite faktörü(QF) ve radyasyon ağırlık faktörü(WR), radyoaktif parçacık ve ışınlar arasındaki ileriye dönük farkı (örneğin malignite riski) hesaplamak için kullanılır. Alfa radyasyonu için wR 20’dir, bu nedenle alfa radyasyonundan kaynaklanan 1 mGy (veya 100 mrad) 20 mSv’ye (veya 2 rem) eşittir. Beta radyasyonunun wR değeri birdir ve nötronlar için bu değer nötron enerjisine bağlı olarak üç ile 20 arasındadır.
1 Gy x 1 = 1 Sv
100 rad x 1 = 100 rem
ABD’de yıllık mesleki olmayan alt limit 0,1 Rem ve 1mSv olarak belirlenirken, mesleki alt limit 5 Rem (5000 mrem) ve 50 mSv olarak belirlenmiştir. Bir akciğer grafisi 10mrem, batın grafisi 120 mrem, beyin tomografisi 200 mrem, toraks tomografisi 700 mrem, batın pelvis tomografisi 1000 mrem, yıllık radyasyon doz limiti 100 mrem/yıl, 60 gün içinde 3,5- 4,5 Gy maruz kalan deneklerin LD50/60 düzeyi 350.000-450.000 mrem (350- 450 rad = 350- 450 rem) olarak belirlenmiştir.
ABD’de, G-M (Geiger-Mueller) dedektörü gibi birçok radyasyon algılama cihazı röntgen (R) birimini veya mR gibi bir alt katını kullanır. R, havadaki iyonizasyonun birimidir.
Bölüm 2. Akut Radyasyon Sendromu
Kısa sürede tüm vücudun ya da bazı bölümlerin 1 Gy’den yüksek radyasyon dozlarına maruz kalınması sonucu, saatler, günler, aylar sonra ortaya çıkan ölüme kadar gidebilen, organ ve sistemlerdeki radyasyon hasarı olarak tanımlanır. Baş dahil, diz ve dirseklerin proksimali tüm vücut olarak tanımlanır. ARS, gastrointestinal, hematopoietik, nörovasküler ve kutanöz organ sistemlerini tek tek veya birlikte tutabilir. Maruz kalınan radyasyon dozu ile kliniğin şiddeti arasında korelasyon mevcuttur. İki veya daha fazla organ sisteminin tutulduğu radyasyona bağlı çoklu organ yetmezliği görülebilir. Diğer travmalar ve enfeksiyonlarla ile birlikte olursa kombine radyasyon yaralanması olarak tanımlanır. Kombine yaralanma durumlarında mortalite artar.
ARS’nin belirtileri ve semptomları, tüm vücut tarafından emilen radyasyon dozu ile ilgilidir. 0,5 Gy’den düşük dozların akut semptomlara neden olması beklenmezken, 4,5 Gy’lik dozlar maruz kalan kişilerin %50’si için öldürücüdür. Sendromun başlangıcı, süresi ve klinik bulguları alınan radyasyon dozuna bağlıdır.
Maruz kalmayı takip eden ilk 2 ay içinde görülen akut değişiklikler, esas olarak deri, CNS, akciğer, GI sistem ve hematopoietik dokulardaki hasardan kaynaklanan belirti ve semptomları içerir. Kutanöz sendrom (CS), üniform olmayan maruziyetin sonucu olarak ARS’li hastalarda özellikle yaygındır. CS, epilasyondan radyonekroza kadar değişen değişiklikleri içerebilir.
2.1. Patofizyoloji
İyonlaştırıcı radyasyon, yüksek dozlarda direkt hücre içine girebilir ve burada etkileşime geçer ya da serbest oksijen radikalleri oluşturur ve bu radikallerle DNA, RNA, proteinler ve plazma zarında hasar oluşturur. Düşük dozlarda ise mitoz bölünmeyi engelleyerek hücr4e bölünmesini duraklatır ve hücresel hasara neden olur. Radyasyon hasarı radyasyona maruziyetten mikrosaniyeler sonra meydana gelir ve hasar kök hücreler, cildin bazal tabakası, lenfositler, testislerdeki sertoli hücreleri gibi hızlı bölünen hücrelerde en fazla görülür.
2.2. ARS ve Doz
ARS saatler ile haftalar sonra başlayan, aşamaları ve sonlanımı alınan doza göre değişen akut bir hastalıktır. 1 Gy üzerinde hematopoietik sendrom, 6 Gy üzerinde gastrointestinal sendrom, 8 Gy üzerinde nörovasküler sendrom görülür. 10-12 Gy üzerindeki dozlarda hayatta kalma şansı yoktur. Belirti ve bulgular arasında anoreksi, bulantı-kusma, ishal, ateş, göze maruziyette konjonktivit ve ciltte eritem yer alır.
ARS prodromal belirti ve bulgu dönemi (maruziyetten 0-2 gün sonra), latent dönem (2-20 gün), belirgin hastalık dönemi (21-60 gün), iyileşme veya ölüm şeklinde dört evreden oluşur. Akut tüm vücut maruziyetinden kaynaklanan erken semptomlar, prodromal radyasyon sendromunu oluşturur. Bu erken belirtiler anoreksi, ilgisizlik, mide bulantısı, kusma, diyare, ateş, taşikardi ve baş ağrısıdır ve radyasyon dozunun büyüklüğüne ve ek yaralanmanın varlığına bağlıdır.
Prodromal sendrom, 1 Gy veya daha düşük toplam vücut dozlarında genellikle hafiftir veya yoktur. Semptomların ilk 2 saat içinde başlaması genellikle 2 Gy’ yi aşan önemli ve potansiyel olarak ölümcül maruziyetleri gösterir. Bu dozlarda, gastrointestinal sendromu semptomatolojiye katkıda bulunur. Yüksek dozlarda (örn. 10 ila 20 Gy), hemen hemen tüm hastalarda maruziyetten sonraki dakikalar içinde prodromal semptomlar ortaya çıkar. Serebrovasküler sendrom göstermeyen ancak gastrointestinal sendrom gelişen hastalar uygun tıbbi destekle hayatta kalabilir. Bununla birlikte, yeterince uzun süre hayatta kalırlarsa hepsi de hematolojik sendromu geliştirecektir. Kutanöz sendrom, yukarıdaki senaryolardan herhangi birinde gelişebilir ve yönetimi karmaşıklaştıracaktır.
2.2.1. Fiziksel Ölçüm
Dozimetriler ve süreç ölçüm cihazları ile yapılır, birkaç çeşit dozimetri mevcuttur. Sıklıkla Geiger sayaçları kullanılır. Acil durumlarda, etkilenen çok sayıda insan varlığında, çok zaman alır ve özel aletlere ihtiyaç vardır. (İyon odaları ve spektroskoplar). Bu durumda kan, idrar, tükrük, dışkı örnekleri, nasal swipe ve soluk üzerinde ölçümler yapılır. Süreç ölçerler çevresel kirlenmeyi ölçmek için kullanılır, belirli bir zaman boyunca belli bir alandaki radyasyon miktarını ölçer.
2.2.2. Biyolojik Dozimetri
Kusmaya başlama süresi ve maruziyet sonrası lenfosit sayısındaki düşüklük, kromozomal anormallik gibi klinik belirti ve semptomlar, maruz kalınan radyasyon dozunu tahmin etmek için kullanılır. Lenfosit sayısındaki düşüşün izlenmesi, radyasyon dozunu değerlendirmek için en pratik yöntem olarak değerlendirilmiştir. Maruziyetten sonraki 12 saat – 7 günlük süreçte lenfosit sayısının en düşük noktası ve düşme oranı kümülatif dozu gösterir. 1-10 Gy arasında eş değer doz aralığını tahmin eder.
2.2.3 Kromozomal Değişiklikler
Disentrik kromozomlar ve kromozom halkaları gibi kromozom anomalilerinin sıklığı radyasyon dozu ile ilişkilidir. Maruziyetten 24 saat sonra veya daha sonra biyodosimetri laboratuvarında incelenmek üzere örnek kan alınmalıdır. İnkübasyon süresi nedeni ile 48-72 saatlik süre sonunda sonuç alınmaya başlanabilir.
2.2.4. Radyasyona Maruz Kalma Şiddetinin Puanlanması- Avrupa Protokolü (METREPOL)
Bu protokol, bilgisayarlı bir rehberlik sisteminin temelini oluşturur. Çok sayıda insanın dahil olduğu bir radyolojik kazadan sonraki ilk 48 saatin çok önemli olduğu konusunda hemfikirdir. Bu süre zarfında, semptomların ortaya çıkmasından önceki süre, kutanöz eritemin gözlemlenmesinden önceki süre, asteni, bulantı yoğunluğu, 24 saatteki kusma sıklığı, ishalin şiddeti ve sıklığı veya 24 saatteki dışkı sayısı, karın ağrısının varlığı, baş ağrılarının yoğunluğu, sıcaklık, kan basıncı ve geçici bilinç kaybı dahil olmak üzere hem klinik hem de biyolojik bulgular, acil durum triyaj sistemine kaydedilmelidir.
1 puan alan hastalar ayaktan izlenebilir veya gündüz bakım hastanesi eşdeğerinde tedavi edilebilir. 2 puan alan hastalar, hayatta kalmak için maksimum tıbbi müdahaleye ihtiyaç duyan hastalardır. 3 puan alan hastalar, çoklu organ yetmezliği (MOF) geliştirmesi öngörülen ve ne yazık ki iyileşme ümidi neredeyse hiç olmayan hastalardır. Radyasyona bağlı çoklu organ yetmezliği (MOF), iki veya daha fazla organ sisteminin zaman içinde ilerleyici işlev bozukluğunu tanımlar.
İlk 48 saat içindeki birincil hedef, ışınlanmaya maruz kalmayanları belirlemektir (puan 0). Bu hastanelerin kapasitesinin üzerinde çalışmasını engelleyecektir.
Hastaneye yatırılan hastalar sadece skoru 1’i aşan hastalardır. Yanlışlıkla bulaşma durumunda sadece uygun şekilde dekontamine edilmiş hastalar kabul edilmelidir.
İlk 48 saatin ardından hastanın skorlaması METREPOL’e göre yeniden değerlendirilir. 2 veya 3 skor alan hastalar, iyileşme umutları olup olmadığına bakılmaksızın önerilen tedaviyi alırlar. Ne yazık ki ilk 48 saat içinde bireysel, fiziksel ve biyolojik dozimetriyi bilmek mümkün değildir: bu önemli bilgilere ancak 48 saat sonra erişilebilir hale gelir ve bu noktada daha fazla tıbbi karar vermenin temeli haline gelirler. Unutulmamalıdır ki, bir bireyin vücudunun hangi kısmının maruz kaldığı, toplam maruz kalma dozundan daha önemlidir.
Bazı yazarlar, katastrofik bir nükleer olay sırasında triyaj için diş ve tırnak dokusunun in vivo elektron paramanyetik rezonans (EPR) dozimetrisi gibi yüksek doğruluklu biyodozimetriye dayalı tarama yöntemleri önermektedir.
2.3. Belirgin Hastalık Dönemi
Prodrom dönemi ve latent dönemden sonra belirgin hastalık dönemi etkilenen sisteme göre ayırt edilen ve klinik olarak birbiri ile bağımlı ve örtüşen üç sendroma bölünmüştür.
2.3.1. Hematopoietik Sendrom
Lenfositler ve kemik iliğindeki kök hücreler radyasyona oldukça duyarlı hücrelerdir. ³1 Gy eşik doz olarak kabul edilir, 2-3 Gy’den fazla dozlarda klinik oldukça ağırlaşır ve tedavi oldukça zorlaşır. Radyasyon maruziyetini takip eden ilk hücre döngüsünden önce etkisi görülmeyen apoptozu indüklemenin yanı sıra radyasyon, lenfositlerin resirkülasyon özelliklerini değiştirir.
Maruziyetten sonraki ilk 24 saat içinde mutlak lenfosit sayısında %50’lik bir düşüş ve ardından 48 saat içinde daha ciddi bir düşüş, potansiyel olarak ölümcül bir maruziyeti karakterize eder. Nötropeni ve trombositopeni 2-4 haftada en alt seviyeye ulaşır ve aylarca devam edebilir. Gastrointestinal sendromdan gastrointestinal kan kaybı, trombositopeniye sekonder organ ve dokulara kanama ve nihayetinde kemik iliği aplazisinin birleşik etkileri nedeniyle anemi kaçınılmaz olarak ortaya çıkar.
Maruz kalmayı takip eden ilk hafta boyunca normalin %50’si içinde kalan bir mutlak lenfosit sayısı, <1 Gy’lik bir maruziyeti ve %90 ın üzerinde bir hayatta kalma olasılığını gösterir. Bununla birlikte lenfopeni, yanıklara ve travmaya eşlik eden streslerden de kaynaklanabileceğinden mümkün olduğunda birden fazla biyodosimetri incelenmesi önemlidir(lenfosit disentrikleri).
Maruziyetten sonraki haftalar ile aylar içinde, kemik iliğinde hipoplazi veya aplazi meydana gelir ve pansitopeniye, enfeksiyona yatkınlığa, kanamaya ve/veya zayıf yara iyileşmesine neden olur ve bunların tümü, uygun destekleyici bakımın yokluğunda ölüme katkıda bulunabilir.
Kısmi koruma sağlanmış olması veya daha ventral şekilde radyasyona maruz kalma ile sağlanan doz homojensizliği, kemik iliğinde daha az hasar anlamına gelebilir. Bu tür korumalar, hematopoezin yeniden oluşmasına katkıda bulunur.
Kan transfüzyonu ve antibiyotik kullanımı gibi destekleyici tedavi ile hastalarda sağkalım artmakta ve LD50/60 dozu (radyasyona maruz kalmış popülasyonun 60 gün içinde, %50’sinde ölüme neden olan doz olarak tanımlanır.) 5-7 Gy’ e kadar artmaktadır. Tedaviye CSF eklenmesi ve yoğun bakım tedavisi sağkalımı daha da arttıracak ve LD50/60 dozu 6-9 Gy’ e yükselecektir. 10-12 Gy’ yi aşan toplam maruziyetin ardından yaşam şansı yoktur.
En yüksek sağkalım oranları 6 Gy ve altında doza maruz kalan komorbiditesi olmayan hastalarda görülür. Nötrofil sayısı 500/mm’ nin altına düştükçe enfeksiyon riski artar. Radyasyona bağlı immunsupresyonu olan hastalarda enfeksiyonun klinik belirti ve bulguları hiç yoktur. Cilt ve gastrointestinal sistem mukozasındaki yarıklar enfeksiyoz ajanların dolaşıma katılmasına neden olur. Şiddetli lenfopeni ve nötropenide önceki viral enfeksiyonların yeniden aktivasyonu gözlenebilir. Erken dönemde antimikrobiyal ajanlar başlanmalıdır.
2.3.2. Gastrointestinal Sendrom
Gastrointestinal sendrom tipik olarak ilk maruziyetten sonraki beş gün içinde gelişir. 1-5 Gy’nin altındaki dozlarda, yalnızca mide bulantısı, kusma ve gastrik atoninin prodromal fazı gözlenir. 5 ile 12 Gy arasındaki dozlarda, bağırsak kript hücrelerinin kaybına ve mukozal bariyerin bozulmasına bağlı olarak daha şiddetli semptomlar gelişir. Bu değişiklikler kramp tarzında karın ağrısı, ishal, bulantı ve kusma, gastrointestinal kanama ile sonuçlanan anemi ve sıvı ve elektrolit dengesinde anormallikler ile sonuçlanır. Bu erken evreyi genellikle semptomların hafiflediği 5-7 gün süren gizli bir evre izler. Yüksek ateşin eşlik ettiği kusma ve şiddetli ishal hastalığı oluşturur. Bu dönemdeki sistemik etkiler, malabsorpsiyondan kaynaklanan yetersiz beslenmeyi içerebilir. Gastrointestinal sistemin bozulmuş bariyer işlevi, bakterilerin ve bunların toksinlerinin bağırsak duvarından kan dolaşımına geçmesine neden olarak enfeksiyona ve sepsise zemin hazırlar; bu durum, hematopoietik sendromun gelişimine sekonder immün baskılama ve sitopeni ile daha da tehlikeye girebilir. Diğer ciddi komplikasyonlar arasında barsak duvarında stenoz, ileus ve perforasyona yol açan ülserasyon ve nekroz yer alır.
Semptomların başlama zamanı dozla ilişkilidir ve ne kadar erken ortaya çıkarsa o kadar yüksek dozda radyasyona maruz kalınmış demektir. 6-8 Gy üzerindeki dozlarda pulmoner etkilenim ortaya çıkabilir. Yoğun bakım tedavileri ile mortalite azalmaktadır.
2.3.3. Nörovasküler Sendrom
8 Gy ve üzerinde kardiyovasküler sistem ve santral sinir sistemi etkilenir. Bu iki sistemdeki bulguların beraber ortaya çıkmasına nörovasküler sendrom denir. Kan beyin bariyerine zarar veren bozulmuş kılcal dolaşım, interstisyel ödem, akut enflamasyon, peteşiyal kanamalar, meninkslerin enflamasyonu ve perivasküler astrositlerin hipertrofisini içerir. Şişlik ve ödem varlığı BT taramaları ve MRG ile belgelenebilir. 10-20 Gy aralığındaki dozlarda, bireyler baş ağrısı, nörolojik bozukluklar ve anormal bilişin eşlik ettiği kalıcı ve şiddetli mide bulantısı ve kusma ile kendini gösterir. Oryantasyon bozukluğu, konfüzyon, denge kaybı ve nöbetleri, çoklu organ yetmezliği görülür. Fizik muayenede papilödem, ataksi ve derin tendon ve kornea reflekslerinde azalma görülebilir.
Bulantı-kusma, yüksek ateş, konfüzyon, hipotansiyon, bilinç bulanıklığı, vasküler instabilite ve bunu takiben ölüm görülür. 8Gy altındaki dozlarda nörolojik semptomlar oluşmaz, eğer nörolojik semptomlar ortaya çıkıyorsa altında nörolojik nedenler haricinde başka bir neden aranmalıdır. 10 Gy üzeri dozlarda geri dönüşümsüz nörovasküler sendrom ortaya çıkar ve mortalitesi %100’ e yakındır
Bölüm 2.4 Tetkik ve Tedavi
Etkin tedavi uygulayabilmek için öncelikle maruz kalınan radyasyon büyüklüğünün tespit edilebilmesi gerekir ve bunun için de kaynak aktivitesinin (A), izotopun ve ilgili gama sabitinin (Γ), kazazedenin kaynaktan uzaklığının (m veya cm) ve bölgede geçirdiği sürenin (t) bilinmesi gerekir.
ARS’de destekleyici önlemler, yoğun bakım takibi, sitokin tedavisi ve tıbbi endikasyon dahilinde antimikrobiyal tedavi hastaların mortalitesini düşürür. Radyoaktif kontaminasyonun ölümcül evreye ulaşması için zaman geçmelidir bu yüzden öncelikle hastanın varsa eğer hayati tehdit oluşturan yaralanmaları tedavi edilmelidir.
Hematopoietik Sendrom:
Gastrointestinal Sendrom:
Nörovasküler Sendrom:
Erken cerrahi ve yara kapatma, invaziv prosedürlerin azaltılması, stres ülserlerini önlemek için proton pompa inhibitörleri başlanması, mümkün olduğunca oral beslenmenin sağlanması, hijyen kurallarına dikkat edilmesi ek öneriler olarak belirtilmiştir.
Bölüm 3. Lokal Yaralanma (Kutanöz Sendrom) ve Tıbbi Tedavisi
ARS ile birlikte ya da izole olarak meydana gelebilir.
Lokal yaralanma bulguları geç ortaya çıkar bu sebeple tanısı anamnez ile konulur. Yüksek seviyeli maruziyet tanısı lezyonların hızla seri olarak ortaya çıkması ile konmuştur. MRI görüntüleme, ultrasonografi ve sitogenetik analizler de tanıya yardımcıdır.
Tedavisi yara bakımı, ağrı yönetimi ve enfeksiyon kontrolü, inflamasyonun giderilmesi, tablonun ağırlaşmasının önlenmesi ile sağlanır. Radyonekroz ve cilt fibrozisi geri döndürülemez bulgulardandır.
Bölüm 4. İnternal Kontaminasyon
Radyoaktif maddenin yurulması, solunması ve yaraların kontamine olması ile meydana gelir. Burun delikleri, ağız kenarı ve içinde, yüzde, yara kenarları ve içinde kontaminasyon olmasıdır.
Soluk yolu ile alınan radyoaktif bir maddenin miktarını tayin etmek için burun deliklerinden sürüntü örneği alınmalıdır. Kontamine olur olmaz örnek alınmalıdır. Her bir burundaki kontaminasyon miktarının toplamı değerlendirmeye alınmalıdır.İlk örnek alımı toplam dozun %10’unu temsil ettiği varsayılır.
Tedavi, hastanın hangi izotopa maruz kaldığına göre değişir. Radyoaktif bozunma ve biyolojik eliminasyon vücudu radyoaktif maddelerden arındırır.
Bölüm 5. Bulaşma ve Dekontaminasyon
Bölüm 6. Radyasyonun Geç Etkileri
6-8 Gy üzeri maruziyetlerde radyasyon hasarı tarafından üretilen reaktif oksijen radikalleri akciğerleri doğrudan hasarlar ve fibrozise kadar ilerleyen enflamasyon ve kronik oksidatif stres döngüsünü başlatır. Radyasyonla ilişkili doku hipoksisi sıklıkla daha fazla akciğer hasarına neden olur. Doza bağlı olarak kuru öksürük ve nefes darlığı ile ortaya çıkan akut radyasyon pnömonisi görülür.
Hiroşima ve Nagazaki olaylarından sonra radyasyonun akut etkilerinden kurtulanlarda kronik Lenfositik Lösemi hariç diğer tümlösemi tipleri görülmüştür. Meme, tiroid, mide, testis, kolon, akciğer karsinomları da bildirilmiştir.
Chernobyl kazasından sonra ise çocukluk ve ergenlik döneminde internal kontaminasyona maruz kalmanın papiller tiroid kanserinde artışa neden olduğu gösterilmiştir.Kazadan yirmi beş yıl sonra, maruz kalan genç insanlarda tiroid kanseri riski önemli ölçüde artmaya devam etmektedir.
Kanser dışında katarakt, bağışıklık sisteminde çökme, intrauterin etkilenen bebeklerde zeka geriliği, mikrosefali izlenmiştir. Son zamanlarda, makul dozlarda iyonlaştırıcı radyasyonun aşırı kardiyovasküler hastalık risklerine katkıda bulunabileceğini gösteren kanıtlar da ortaya çıkmıştır.
Bölüm 7. Gebeler
Radyasyona maruziyet erken dönemlerde olursa ya hep ya hiç etkisi görülür ve implantasyon başarı ile sonuçlanırsa gebelikte sorun gözlenmez. İlk ikşi haftada 0,1 Gy’den daha büyük bir maruziyet genellikle abortusla sonuçlanır. İlk trimesterde radyosensitif hücreler fazla sayıdadır ve radyasyona karşı oldukça hassastır. 0,5 Gy’den fazla dozlarda büyüme geriliği, mikrosefali, konjenital malformasyonlar gözlenmektedir fakat MSS etkilenmediği durumlarda herhangi bir malformasyon izlenmemektedir. En yüksek zeka geriliği riski, fetüsün majör nöronal göç döneminde (8-15 hafta) ışınlanmasıdır ve insidans doza bağımlıdır. 16-25 haftalık gebeliklerde 0,5 Gy doz radyasyona maruziyette zeka geriliği bildirilmemiştir. Yüksek düzeyde radyasyon çocukluk çağı lösemisinde önemli bir risk faktörüdür.
Bölüm 8. Acil Müdahale Planlaması
Tanım olarak, insan üzerinde psikolojik ve fiziksel tahrip yaratmak üzere kimyasal maddelerin zehirleyici özelliklerinden faydalanılarak üretilmiş maddelere, kimyasal silah denmektedir. Her daim çatışmaların yaşandığı coğrafyamızda ve son dönemde Ukrayna-Rusya savaşında tekrar tartışma konusu olan kimyasal silahlar dünyada belirli aralıklarla gündeme gelmektedir. Bu yazıda 2018 yılında Toxicology Letters’da yayınlanan Chemical warfare agents. Classes and targets (1) makalesini incelemeyi hedefledik.
Giriş
Sentetik zehirli kimyasallar (maddeler) ve biyolojik zehirler son yüzyılda kimyasal silah olarak geliştirilmiştir. Bu maddelerin etki mekanizmaları ile ilgili bilgiler sınırlıdır.
Kimyasal savaş ajanlarının sınıflandırılması
Kimyasal silahlar; tarihsel gelişim, fiziksel ve kimyasal etkiler, reaktivite ve hedef organlara yönelik olarak sınıflandırılabilirler.
Hardal ve arsenik gibi bazı kimyasal maddeler, geçmişte kimyasal silah olarak dönüştürüldükleri için kimyasal savaş ajanları olarak adlandırılırlar. Saxitoksin gibi bazı maddeler ise, kimyasal silah olarak geliştirilmiş olup, günümüze kadar olan savaşlarda kullanılmamış bir ajandır. Kimyasal Silahların Yasaklanması Örgütü (Organisation for the Prohibition of Chemical Weapons), 2005 yılından beri yasaklanmış kimyasal silahları derleyen ve kullanımına karşı çalışmalar yürüten bir organizasyondur.
Kimyasal özelliklerine göre; organik-inorganik, uçucu-uçucu olmayan, reaktif-reaktif olmayan, biyolojik-sentetik olarak sınıflandırılabilirler. Bazı potansiyel kimyasal savaş ajanları ve bazı öncüler, endüstriyel kimyasal işlemlerde büyük ölçekli ara ürünler olup, teknik olarak kimyasal fabrikaların harici kullanılabilir. Örneğin su dezenfeksiyonu için klor veya kozmetik ve terapötik uygulamalar için botulinum toksini kullanılmaktadır.
Tüm kimyasal savaş ajanları akut etki göstermeyi hedefler ancak hepsi aynı oranda hayatı tehdit etmezler. Bazıları dakikalar içinde öldürürken (AChE inhibitörleri), bazılarının saatler süren asemptomatik latent periyodları vardır (fosgen gazı). Etkisiz hale getirmek için kullanılan maddeler insanları geçici olarak sakatlar. Taciz edici ajanlar genelde hayati olmayan organları etkilerler. Bunlara örnek biber gazı gibi göz yaşartıcı gazlar verilebilir.
Reaktif, korozif maddeler; maruz bıraktığı göz, deri, havayolu gibi vücut bölgelerine zarar vermeyi hedefler. Buna karşılık, aşındırıcı olmayan toksik ajanlar, genellikle başlangıçta maruz kalınan organdan farklı spesifik bir biyolojik hedefle etkileşime girer.
Etkileyen faktörler
Bir ajan; gaz, likid aerosol, solid aerosol, sıvı, yapışkan madde veya cephane halinde bulunabilir. Kurbanların çevresindeki madde konsantrasyonu buharlaşma basıncı, hava hareketleri, sıcaklığa bağlı olarak değişebilir. İnternal maruziyet; temas süresi, solunum sayısı, cilt nemlilik oranı gibi faktörlerle değişir.
Aşırı aktif havayolu, yaş, cinsiyet, vücut büyüklüğü (çocukların burnu yere daha yakındır), vücut ağırlığı, hedef proteinlerdeki polimorfizm veya biyotransfer enzimleri maruziyeti etkileyecek durumlardır.
Etki mekanizmalarında genel dikkat edilecek noktalar
Botulinum toksini ve organofosfatlar gibi bazı ajanlar yalnız seçilmiş biyokimyasal yolak ve reaksiyonları ve bazı hücre tiplerini etkilerler. Diğer uçta ise, hardal gazı gibi, maruz kalan her tür dokuda çok çeşitli biyomoleküllere saldıran ve onları alkilleyen bazı yüksek reaktif kimyasallar bulunur.
TRP kanalları tüm hücre tiplerinde bulunur, ancak duyu sinir uçlarında bol miktardadır. TRP kanalları fiziksel ve kimyasal olarak sıcaklık, membrandaki aksiyon potansiyeli değişiklikleri, osmotik stres, endojen inflamatuar mediatörler, ve kimyasal ajanlarla aktif hale gelebilirler. Bu reseptörlerin birçok sağlık sorununda aktif rol oynadığı düşünülmektedir.
TRPV1-TRPA reseptörleri spesifik olmayan kemosensörlerdir. Daha önceden kapsaisin reseptörü veya vanilloid reseptör olarak da adlandırılan TRPV1 reseptör biberden kaynaklı yanma hissini alır. TRPA reseptörleri ve alkali ajanlar, endotoksinler ile ilişkisi çalışma konusudur. Bu reseptörler sinerjistik etki gösterebilirler. TRPM8 reseptörü akciğer ve havayolu sistemlerinde kemoreseptör olarak rol oynarlar.
Toksik hücre hasarı nekroz ve apopitoza sebep olabilir. Bunlar hasarlı hücrenin kendinden (intrinsik yol) veya komşu hücrelerinden (ekstrinsik yol) kaynaklı olabilir.
Etki mekanizmaları
Sinir sistemini etkileyenler
Birçok kimyasal silah için kolinerjik sinaps aralığı hedeftir. AChE-inhibitörleri (organofosfatlar veya sinir kimyasalları/gazları) son 30 yılda 5 milyondan fazla insanın hayatını kaybetmesine sebep olmuştur. Zehirlenmenin en sık kaynağı bilinçli veya bilmeden alınan insektisitlerdir. Yıkıcı toksik etkileri, 1995 Tokyo metro saldırısında kullanılan sarin ile görülmüştür.
Tabun, sarin, soman ve VX gazı bu gruba girer. Tamamı AChE’yi sinaps ve kavşak sonrasında inhibe eder. VX gazı en toksik ve ciltten emilebildiği için en tehlikelisi olarak görülür. Eritrositlerdeki AChE ve kan plazmasındaki butirilkolinesteraz inhibisyonun tanı belirteci olarak kullanılır.
Muskarinik ve nikotinik ACh-reseptörleri santral ve periferik sinir sisteminin farklı hiyerarşik bölümlerinde görev alırlar. Otonom sinir sisteminde, AChE inhibitörlerinin etkisi sonucu pupillerde daralma, bronkokonstrüksiyon, gastrointestinal motilitede artış, terleme, kardiyak aktivitede artma görülebilir. İskelet kaslara etkileri sonucu fasikülasyonlar, seğirmeler, paralizi, beyne olan etkilerinden kaynaklı olarak konfüzyon, ataksi, nöbet ve koma görülebilir. Bronkokonstrüksiyona veya SSS depresyonuna bağlı solunum yetmezliği karakteristik ölüm sebebidir.
Saxitoksin ve ilişkili toksinler, paralitiktir, kabuklu deniz hayvanları zehirlenmelerinin sebebidir. Voltaj kapılı sodyum kanallarını selektif inhibe eden, çok güçlü bir nörotoksini vardır. İlerleyen flask paralizi ile kendini gösterir ve solunum yetmezliğine sebep olabilir.
Botulinum toksini bilinen en güçlü zehirlerdendir. Zehirlenme bulguları; kraniyal sinir paralizileri, görme problemleri, yutma güçlüğü ve konuşma zorluğu olabilir. Zehirlenme ilerledikçe sırtta ve ekstremitelerde güçsüzlük, flask paralizi ve solunum yetmezliği görülebilir.
Nikotin, bitkisel insektisittir. Tütün ürünlerinde bulunur. Nikotin farmakolojik ve toksik etkisini kolinerjik sinir sisteminin nikotinik reseptörlerine bağlanarak ve bunları aktive ederek gösterir. Nikotinin silah olarak kullanımı yakın zamanda evrimleşmiştir.
Kan ürünlerini etkileyenler
Karbonmonoksit, hidrojen siyanid ve siyanogen klorid genellikle kan gazları olarak sınıflandırılır, hücresel solunumu baskıladıkları için genelde yanıltıcıdırlar.
Arsine, hafif sarımsak benzeri kokuludur, renksizdir, yarı-iletkenlerin sentezinde kullanılır. Havadan ağırdır ve düşük konsantrasyonlarda bile ölümcüldür. Kimyasal silah olarak kullanılması önerilmiş olsa da silah haline getirilememiştir. Arsine gazı zehirlenmesi bulguları klinik olarak inhalasyonu takiben 4-6 saat sonra başlar. Baş ağrısı, bulantı, kusma gibi bulguları vardır. Zehirlenmenin birincil mekanizması anemiye sebep olacak şekilde masif hemolizdir. Böbrek yetmezliği sık görülür, idrar koyu kırmızıdır. Solunum yetmezliği gelişebilir.
Havayolu ve akciğeri etkileyenler
Bu grup “boğucu ajanlar” olarak da adlandırılır. İrritan, korozif ve/veya kimyasal olarak yüksek oranda aktif gaz ve aerosoller bu gruba dahildir. Hava Yollarında bulunan TRP reseptörleri bir çok akciğer hastalığının patogenezinde rol oynadığı gibi bu yolla zehirlenen hastalarda da mekanizmada görev alır.
Fosgen (karbonil diklorür) basit formüllü bir kimyasal silahtır. Solunduğunda TRP reseptörleriyle etkileşime geçerek akciğer toksisitesinde rol oynadığı düşünülmektedir. Su ile temas ettiğinde, karbondioksit ve hidroklorik aside ayrışır, asit kaynaklı hasara neden olur. Maruz kalan insanlar, önce havayolu irritasyonunu hissedebilir, takiben alveollerde hasar ve onarım kaskadı, lokal inflamatuvar yanıt, kan akımında azalma ve bronkokonstrüksiyon durumlarını içeren, semptomsuz olabilen bir latent periyoda girerler. Bu doku hasarları sonunda dokular arasına su geçişi ve alveollere su geçişi sonrası intestinal ve akciğer ödemi gelişir. Bu da gaz alışverişini bozar ve solunum yetmezliği geliştirir. Solunan fosgen gazının birincil hedefi akciğer olmasının yanısıra deriyle temas sonrası deri irritasyonu ve eritem görülebilir.
Deri ve yüzey dokuları etkileyenler
Deriyi hedef alan kimyasallar genellikle yağlı ve yapışkan olması itibariyle uzun etkili ve karakteristik cilt bulgularına yol açarlar. Hardal yağına benzeyen kokularından dolayı hardal ajanları bu ismi almıştır. Temel olarak kükürt ve azot hardalları olarak 2 çeşit hardal ajanı vardır. İkisi de kimyasal olarak kararlı değildir. Guanine bağlanması DNA kırılmalarına ve çapraz bağlara neden olur, bu da hücresel onarım ve/veya ADP-ribozilasyon gibi bozulma sinyalleri için bir kontrol noktası oluşturur; bu da apopitozu başlatabilir. Yağ asitleri ile etkileşimi membran hasarına neden olabilir. Kükürt hardalının cilt etkileri genellikle yarım gün sonra veya daha uzun sürede ortaya çıkar, azot hardallarının ki daha hızlı ortaya çıkabilir. Erken dermatolojik semptomlar kaşıntı, eritem ve ödemi içerir. Havayolu hasarı, hardal ajanlarına bağlı ölümlerde, genelde son sebeptir. Kükürt hardalları doz bağımlı olarak ackiğer TRPA1 reseptörlerini aktive eder. Hardal ajanları ilişkili göz hasarı geri dönüşümsüz olabilir.
Fosgen oksim buharı hoş olmayan bir kokuya sahiptir ve güçlü bir tahriş edicidir. Semptomlar hardal ajanlarına benzer, ancak daha hızlı ortaya çıkar. Madde deriye nüfuz eder ve anında ciddi deri hasarına neden olur.
Lewisite, lipofilik bir sıvıdır ve deri yoluyla kolayca emilir. Deride ani yanma hissine, eritemle birlikte ağrılı deri iltihabına ve ardından kabarmaya neden olur. Gözler ve solunum yolları da başlıca hedef organlardır. Sistemik toksisite kapiller duvarı bozar, kan volümünün kaybına ve Lewisite şoku tablonun ortaya çıkmasına sebep olur.
Hücresel solunumu etkileyenler
Hücresel solunumu etkileyen ajanlar kanda oksijen taşınmasını veya mitokondriyal düzeyde oksidatif fosforilasyonu bozarak etki gösterirler. Karbonmonoksit (CO) hücrelere oksijen sunumunu bozar, hücrelere oksijen sunumu azalır ve mitokonriyal ATP sentezi durma noktasına gelir. Yüksek oksijen ihtiyacı olan organlar birincil olarak etkilenirler. Azalmış beyin aktivitesine ikincil olarak baş dönmesi, sersemlik, bilinç kaybı ve son olarak ölüm görülür.
Hidrojen siyanür ya da daha doğrusu siyanür anyonu Fe+3 formundaki heme karşı bir afiniteye sahiptir. Siyanür, hemoglobinin oksijen taşımayan Fe+3 formu olan methemoglobine sessizce bağlanır ve kanda oksijen taşınmasını azaltmaz. Başlıca toksik hedef mitokondride bulunan sitokrom c oksidazdır. Blokajı oksidatif fosforilasyonu bozar ve hücresel ATP eksikliğine neden olur. Semptomlar içinde bulantı, nöbet, solunum sıkıntısı, apne, kardiyak arrest vardır.
Siyanid klorür ilk olarak reaktivitesi nedeniyle gözler ve solunum yolları için güçlü bir tahriş edicidir ve hızla boğulmaya neden olur. İkinci olarak, kana karıştığında, kırmızı kan hücreleri onu hidrojen siyanüre dönüştürür ve bu da sitokrom c oksidazı inhibe eder.
Diğer hücre fonksiyonlarını etkileyenler
Risin 50 yıl önce siyasi bir cinayette kullanıldıktan sonra dikkat çekmiştir. Ağız yoluyla alındıktan sonra toksik etkiler gastrointestinal mukoza üzerinde gerçekleşir. Solunum yoluyla alınması sonrası sistemik etkilenim görülür. Risin AB toksinler grubuna dahildir. A proteininde enzimatik aktivite vardır ve B zinciri ise hücre yüzeyindeki galaktoz artıklarına bağlanan lektindir. AB kompleksi hücre içine endositoz ile alınır. A zinciri ribozomlarda serbest kalır. Protein sentezi inhibisyonuyla semptomların başlaması arasında latent periyot vardır. Solunum yoluyla alınan risin öksürük, ateş ve akciğer hasarına neden olur.
Şarbon sporları Gruinard isimli İskoç adasında 1942 yılında muhtemel biyolojik silah olarak denenmiştir. Bacillus anthracis yüksek oranda bulaşıcı olmasının yanısıra, 3 adet oldukça potent toksin proteini üretmektedir. Bu toksinlerin etkisiyle apopitoz ve hücre ölümü gerçekleşir.
Osmium tetroksid son derece zehirli olarak bilinir. Havayollarına, gözlere ve cilde güçlü irritan olarak etki eder. Semptomları kükürt hardallarına benzerdir.
Bu ajanlar bireylere öldürücü zararlar vermeden hareket etmelerini veya savaşmalarını önleyici olarak etki gösterirler.
Sakinleştiriciler
Carfentanil, yalnızca büyük hayvanlarda sedatif olarak kullanılması için onaylanmıştır. Morfin reseptörleri üzerinden etki eder. Morfin reseptölerinin karakteristik özelliği olarak solunum depreyonu yapabilir.
Izofloran, Moskova tiyatro saldırısında kullanılan uyutucu aerosollerden biri olarak düşünülse de böyle bir anestezik kokteylin büyük bir salonda uyutucu ve güvenli dozda verilmesi pek mümkün değildir.
3-Quinuclidinyl benzilate (QNB) psikoaktif bir uyarıcıdır. Görünür duman şeklinde aerosol haline getirilebilir. Yapısal olarak atropine benzer ve muskarinik reseptörleri yarışmalı olarak antagonize eder. Etkisiz hale getirme fonksiyonları 2-3 saat sonra başlar. Uyku hali, konfüzyon, dezoryantasyon ve apati görülebilir.
Halusinojenler
LSD 1960’larda özellikle illegal uyuşturucu madde olarak kullanılan, kimyasal silah ajanı potansiyeli olan bir maddedir.
Kusma ajanları
Kusmanın, kötü koku, bozuk yiyecek, gebelik, taşıt tutması, kemoterapi, gastrointestinal hastalıklar, intrakraniyal hadiseler ve kimyasallar gibi bir çok sebebi vardır. Duyu ve motor vagus sinirleri önemli olmakla birlikte,TRPV1 reseptörleri de kusma da rol oynamaktadır. Kusturucu ajanlar tipik olarak arsenik ilişkili ajanlardır.
Difenilaminklorarsin, hapşırma ilacı olarak da bilinen pudra veya aerosol şeklinde bir maddedir. Birkaç dakika içinde hapşırmayı tetikler, yüksek dozlarda bulantı, kusma, baş ağrısına sebep olabilir. İstenmeyen etkiler, maruziyet sonrası hemen kaybolurlar ancak ciddi hastalık ve hatta ölüm dahi görülebilmektedir.
Difenilklorarsin ve difenilsiyanoarsin, bağlantılı birincil etkileri vardır. Öksürüğü, gözlerde yanmayı, hava yollarında ve akciğerde yanmayı tetikler.
Göz yaşartıcılar
Göz yaşartıcı gazlar gözlerde yanma hissine sebep olurlar ve lakrimal bezi uyararak gözyaşı salgılanmasına sebep olurlar.
Alfa kloroasetofenon (CN), o-klorobenziliden malononitril (CS) ve biber türevi oleoresin capsicum (OC) bu grubun temsilcisidir.
Kötü kokular
Kötü kokular halsizlik ve kaçış refleksi yaratır. Bütanethiol gibi merkaptanlar son derece düşük eşik seviyesine sahip kötü bir kokuya sahiptir.
Sonuç olarak kimyasal silahların yasaklanması büyük bir insani başarıdır. Mevcut kimyasal silah listelerine yenilerinin eklenmemesi herkesin temennisidir. Ancak, kara listede yer alan yeni eğlence ilaçlarının devam eden gizli sentezine benzer şekilde, potansiyel yasadışı faaliyetlerin de farkında olmak gerekir. Bu tür bilinmeyen tehditler karşısında, hazırlıklı olmak, bilgileri güncellemek, analitik yöntemleri uyarlamak ve uygun terapötik yöntemler geliştirmek önemlidir.
1. Chemical warfare agents. Classes and targets. Schwenk, Michael. 293, basım yeri bilinmiyor : aToxicology Letters, 2018.
| Ocak | Türkiye’nin Toksikoloji Haritası, 2022 | Prof. Dr. Ayça Açıkalın Akpınar |
| Şubat | Dünya nereye gidiyor? Kimyasal Savaş Ajanları | Uzm. Dr. Ömer Taşkın, Moderatör Ayça Akpınar |
| Mart | Radyasyon Yaralanmaları | Uzm. Dr. Senem Koca, Moderatör Prof. Dr. Ayça Açıkalın Akpınar |
| Nisan | Amanita Phalloides Zehirlenmesinin Yönetimi | Uzm. Dr. Oğuz Tuğcan, Moderatör Doç. Dr. Nezihat Rana Dişel |
| Mayıs | Çocukluk Çağı Zehirlenmelerinde Kullanılan Antidotlar | Prof. Dr. Arzu Denizbaşı |
| Haziran | Doğa uyanıyor, yılan akrep sokmalarında, güncel tedavi, antivenom uygulamaları | Doç. Dr. Müge Gülen |
| Temmuz | Deniz sezonu açıldı, Deniz canlıları ile olan zehirlenmeler | Uzm. Dr. Şadiye Mıdık- Moderatör Prof. Dr. Ataman Köse |
| Ağustos | Gabapentin and Pregabalin zehirlenmeleri | Dr. Öğr. Gör. Akif Yarkaç Moderatör Prof. Dr. Ataman Köse |
| Eylül | Chloroquine, Hydroxychloroquine, and Quinine Poisoning | Uzm. Dr. Emre Kudu |
| Ekim | Toksikolojide Lipid kullanımı ve güncel bilgiler | Öğr. Gör. Dr. Çağrı Safa Buyurgan Moderatör Prof. Dr. Ataman Köse |
| Kasım | Piretroid grubu insektisid Zehirlenmeleri | Prof. Dr. Ataman Köse |
| Aralık | Metanol zehirlenmesi ve uzun dönem klinik sonuçları | Uzm. Dr. Giray Altınok Moderatör Prof. Dr. Seyran Bozkurt Babuş |
Zehirlenmeler ülkemizde çoğu merkezde, acil servis başvurularının ortalama yüzde %1-4’ünü oluşturmaktadır. 40 yaş altı ölümlerin %5-6’sı direkt zehirlenme nedeniyle olurken, yaklaşık %21’i özkıyım nedeniyle gerçekleşmektedir. Acil tıp uzmanları, her geçen gün daha kalabalık acil servislerde, dünyada gerçekleşen savaşlar, pandemiler, afetler nedeniyle farklı toplumsal problemlerin yansımasıyla karşı karşıya kalmaktadır. Bu kalabalık acil servislerde, ülkemizde ne tür zehirlenme olaylarıyla karşı karşıya olduğumuzu bilmek, özellikle nadir görülen, ölümcül olabilen zehirlenme hastalarının yönetimindeki zorlukların acil servis, hastane, il ve ülke bazında iyileştirilebilmesini sağlamak, hem çalışan, hem de hasta güvenliği açısından önemlidir. Bu konuyu irdeleyecek olursak;
Soru 1) Dünyada ve ülkemizde son yıllarda suistimal edilen yaygın madde tipleri nelerdir? Ülkemiz ve acil servislerimiz için ne tür riskler oluşturmaktadır?
Dünya uyuşturucu haritasına baktığımızda, ülkemiz jeopolitik konumu nedeniyle maalesef küresel uyuşturucu trafiğinin anayolları üzerinde bulunmaktadır. Tüm dünyada, sadece intravenöz madde bağımlı sayısının 11.2 milyon olduğu tahmin edilmektedir. Buna diğer suistimal yolları da eklendiğinde (oral, intranazal, inhalasyon vb.) maalesef sayı oldukça artmaktadır. Gelişmekte olan kalabalık nüfuslu ülkelerde, madde kullanımı giderek artmaktadır. Ayrıca yaşadığımız Covid 19 pandemisi işsizlik, yoksulluk, eğitimde aksama, yaşanan ruhsal sıkıntılar nedeniyle madde bağımlılığı riskinde artışa katkıda bulunmuştur. Türkiye genelinde yürütülen TURBAHAR (Türkiye Bağımlılık Risk Profili ve Ruh Sağlığı Haritası Projesi, 2019) çalışması verilerine göre, ülkemizde 18 yaş üstü tek tip madde kullanım oranının ortalama %4.5 olduğu bildirilmiştir. Dünya uyuşturucu haritasına bakıldığında, metamfetamin türevlerinin trafiği ve kullanımına dikkat çekilmiştir. Emniyet Genel Müdürlüğü, Narkotik Suçlarla Mücadele Daire Başkanlığı’nın verilerine gore, (Türkiye Uyuşturucu Raporu ve Narkolog verileri) 2020 ve 2021 yıllarında neredeyse her ilimizde metamfetamin türevlerine rastlanılmaktadır. 2015-2019 yıllarında, küresel boyutta ele geçirilen Amfetamin Tipi Sitümülanların, %72’si metamfetamin, %19’u amfetamin ve %4’ü ecstasy’dir. Önümüzdeki dönemin en büyük tehdidinin bu madde olacağı düşünülmektedir. Narkotik Suçlarla Mücadele Daire Başkanlığı, metamfetaminin yarattığı sağlık sorunlarının yanında, toplumsal güvenlik zaafiyetine neden olabileceği konusunda vatandaşları uyarabilmek için kaynaklar yayınlamıştır. Metamfetamin, eksite deliryum tablosuna yol açarak, kolluk kuvvetleri ve acil servis çalışanları için kontrol altına alınması güç tablolara yol açabilirler. Kişilerde sempatomimetik bulguların yanısıra (takipne, aşırı terleme, ajitasyon, taşikardi, hipertansiyon, hipertermi) polise itaatsizlik, sürekli ağır fiziksel aktiviteye rağmen yorulmama, olağan dışı insanüstü güç gibi, kontrol altına alınmasında ciddi zorluk yaşanan semptomlara yol açmaktadır. Bu konuda acil servis güvenliğinin, çalışan ve diğer hastalar için sağlanması, gerekli önlemlerin planlanması gerekmektedir.
Madde alımına bağlı ölümler incelendiğinde, 2017’ye kadar sentetik kannaboidler ön planda iken, son yıllarda metamfetamine ve uyarıcı özelliği olan diğer maddelerde artış görülmekte ve adli tıp verileri incelendiğinde, çoklu madde alımlarına bağlı ölümlerin ön planda olduğu tespit edilmektedir. Özellikle farklı uyarıcı maddelerin birarada alınması durumunda, sempatomimetik sendrom gelişmekte, kardiyotoksisite ve nörotoksisite nedeniyle ani ölüm sıklığı oldukça artmaktadır.
2018-2023 Uyuşturucu ile Mücadele Eylem Planında (UMEP) “Atık Sularda Uyuşturucu Madde Miktarının Tespit Edilmesinin Sağlanmasına” yönelik çalışmalara başlanmış ve ilgili paydaşlarla yaygınlaştırılması amaçlanmıştır. Bu kapsamda, 15.02.2018 tarihli Bağımlılıkla Mücadele Yüksek Kurulu Kararı uyarınca atık su analiz çalışmasının, Türkiye Yeşilay Cemiyeti sorumluluğunda olmak üzere Adli Tıp Kurumu, İçişleri Bakanlığı ve Sağlık Bakanlığı iş birliğinde yapılmasına karar verilmiştir. Dünyada ki farklı büyük kentlerdeki sonuçlarla, İstanbul ve Adana’nın karşılaştırılması aşağıda görülmektedir.
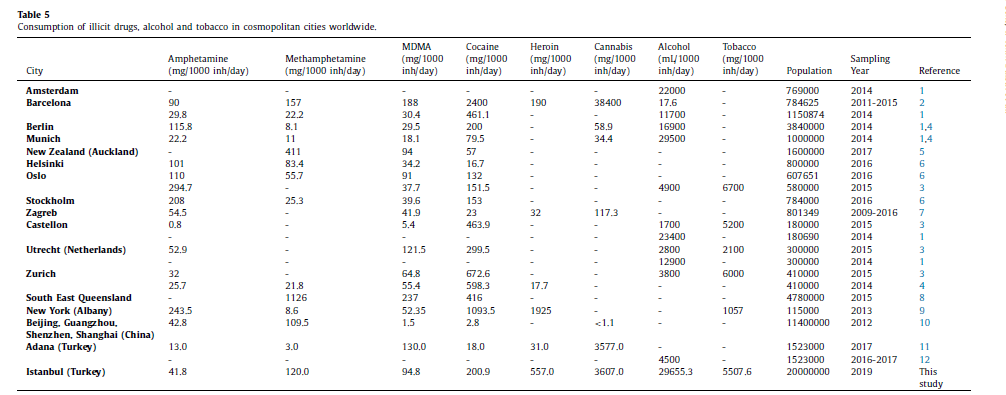
Soru 2) Ulusal Zehir Danışma Merkezi (UZEM) 2014-2020 yılları arasındaki verileri yayınladı. Acil servislerimiz için dikkat çeken veriler nelerdir?
Öncelikle UZEM’in verileri bildirim yoluyla elde edilmektedir. Bunu belirtmekte fayda var. UZEM’e bildirilen vakalara dayanan istatistiklerle veriler oluşturulmaktadır. Veriler incelendiğinde, zehirlenmelerin en sık nedeninin, özkıyım amaçlı oral yolla ilaç alımı olduğu görülmektedir. Oral yolla en sık insan sağlığı ürünleri (%70.69), ev kimyasalları (%9), tarım kimyasallarının(%4.2) bildirildiği dikkati çekmektedir. Tarım kimyasalı bildirimlerinin, son yıllarda artmakta olduğu görülmüştür. Tarım kimyasallarının akut maruziyetleri yanında, kronik maruziyete sebep olan tarım ilacı kalıntıları, sebze ve meyve ihracatında oldukça önemli bir noktadır. Tarım kimyasalları ile ilgili UZEM’de oldukça ayrıntılı veriler mevcuttur. Akut maruziyetlerin, kimyasal tipleri değerlendirildiğinde, en sık birinci sırada warfarin türevi rodentisitler dikkati çekerken, 3. sırada organik fosfatların yer aldığı görülmektedir. Rodentisitlerin bazı türleri oldukça mortal zehirlenmelere yol açmaktadır. Ülkemizde kullanılması yasak olan, striknin gibi türlere bağlı zehirlenmelerin, özellikle İç Anadolu Bölgesi’nden bildirildiği yayınlar mevcuttur. Başka bir tür rodentisit olan, Alüminyum fosfid’te çok mortal zehirlenmelere yol açmaktadır. Ulusal yayınlara bakıldığında Akdeniz Bölgesi’nden bildirilmiş akut mortal zehirlenmelere ek olarak, Türkiye’nin her bölgesinden bildirilen kazara ya da özkıyım amaçlı alüminyum fosfit zehirlenmelerine ait yayınlar mevcuttur. Her ne kadar tarım kimyasallarının satışına, Tarım Bakanlığı tarafından denetim kontrol uygulansa da, kişilerin bilinçsiz kullanımı ve suistimali zehirlenmelere yol açmaya devam etmektedir.
UZEM raporunda, maruz kalınan zehirlenme ajanlarına bakıldığında, dikkat çeken bir maddenin de siyanür olduğu izlenmiştir. 2019 yılında 132 siyanür zehirlenme vakası bildirilmiştir. Bu hastaların bakımında, ilk yardımında olay yerinden başlayarak acil servislerde, kişisel koruyucu ekipmanların kullanımı oldukça önem arzetmektedir. İnhalasyon yoluyla ciddi zehirlenmelere yol açabilen bu ajan, çok hızlı mortal zehirlenmelere sebebiyet verebilir. Antidot temininde hız önemlidir. Ulusal zehir danışma merkezinden zehirlenme bildirimi ile beraber antidot sağlanması için gerekli işlemler başlatılmalıdır. Bölge ve il bazlı antidote temin merkezleri mevcuttur. Bu merkezlerden siyanokit temin edilebilir.
Soru 3) Ülkemizde zehirlenme kaynaklı ölümler incelendiğinde karşımıza çıkan etkenler nelerdir?
40 yaş altı ölüm nedenlerine bakıldığında, yaklaşık %21’inin özkıyım, %5-6’sının zehirlenmeye bağlı ölümler olduğu bilinmektedir. Çocuklarda zehirlenmeye bağlı ölüm nedenleri incelendiğinde, karbonmonoksit zehirlenmeleri ve ilaçlara bağlı ölümler, ilk sıralarda yer alırken, insektisitler, mantar zehirlenmeleri ve yılan ısırıkları sırasıyla gelen nedenler olmaktadır.
Yetişkinlerde ise ölüme sebebiyet verebilen, şok ve akut organ yetmezliği yapan zehirlenme nedenlerine bakıldığında, metil alkol zehirlenmeleri, kardiyovasküler ilaç aşırı alımları, tarım kimyasalları, karbonmonoksit zehirlenmeleri ilk sıralarda yer almaktadır. Son yıllarda zehirlenmelere bağlı yetişkin ölümleri incelendiğinde, metil alkol zehirlenmelerinin ön planda olduğu, takiben tarım kimyasalları, ilaçlar (KVS ilaçları, parasetamol, kolşisin vb.), karbomonoksit, mantar zehirlenmeleri olduğu görülmektedir. Metil alkol zehirlenmelerinde, bu hastaların hastane acil servislerinden hemodiyalize erişim sürelerini kısaltacak, il ve hastane bazında oluşturulan algoritmalar, hayat kurtarıcı olup kalıcı körlük gibi sekel oranlarını da oldukça azaltacaktır.
Karbonmonoksit zehirlenmeleri tüm dünyada olduğu gibi ülkemizde de halen çok mortal sonuçlar doğurabilen bir nedendir. Ülkemizde 2013-2017 yılları arasında mortalite hızının en yüksek olduğu şehirler Manisa ve Balıkesir olarak bildirilmiş olup, tablo aşağıda verilmiştir. Endikasyonu olan hastalarda, hiperbarik oksijen merkezlerine ulaşım mortaliteyi ve kalıcı sekelleri önleyecektir. Mekanik ventilasyon ihtiyacı olan, ağır komatöz karbonmonoksit zehirlenmesi olan hastalarda ise, ekstrakorporeal çıkarım metodu olarak eritrosit aferezi uygulanmış vakalarda, bildirilen iyi sonuçlar mevcuttur.
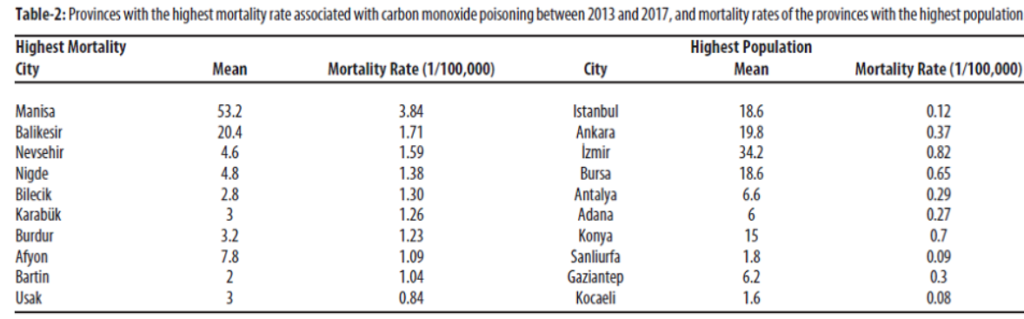

4) Ülkemizde venomu olan canlılara bağlı zehirlenmelere baktığımızda,
Venomu olan canlılara bağlı zehirlenme vakalarından, 2019 yılında UZEM’e bildirilen 3560 vaka olduğunu görüyoruz. Türkiye’nin her bölgesinde bu vakalara rastlansa da, Akdeniz, Güneydoğu Anadolu Bölgesi ve Ege Bölgesi’nde sıklığı daha fazladır. Bu vakaların neredeyse tamamı bahar ve yaz aylarında karşımıza çıkmaktadır. Genellikle ilk sırayı akrep sokmaları alırken, 2. sırada yılan ısırığına bağlı zehirlenmeler gelmektedir. Yılan ısırıkları ve akrep sokmalarına bağlı zehirlenmeler ölüme sebebiyet verebilir. Yılan ısırığına bağlı, dakikalar içerisinde oldukça ağır mortal tablolar ortaya çıkabilir. Bu hastalara hızlıca antivenom verilmesi hayat kurtarıcı olacaktır. Son yıllarda deniz canlıları ile olan zehirlenmeler dikkati çekmekte, özellikle balon balığının yanlışlıkla besin olarak tüketilmesine bağlı ölümcül zehirlenme tablolarıyla karşılaşılmaktadır. Ege Bölgesi ve Akdeniz Bölgesi’nden bildirimler daha fazladır. Balon balığında bulunan tetradotoksin ısıya dayanıklı bir toksindir. Pişirilmekle denature olmaz. Halkın balon balığı gibi ölümcül zehire sahip deniz canlıları konusunda bilgilendirilmesi, bunların dış görünüşlerinin bilinerek tüketilmemesi, bu zehirlenmeleri oldukça azaltacaktır.


Ülkemizde Örümcek sokmasına bağlı da bildirimler mevcuttur (UZEM’e bildirilen örümcek ısırığı sayısı 128). Aslında örümcek ısırığına ikincil zehirlenmeler nadiren acil servislerde karşımıza çıkmaktadır. Ülkemizde toplumda en sık görülen kahverengi keşiş örümceğine bağlı lokal toksisitedir, oldukça ağır lokal hasara yol açabilir. Sistemik toksisitesi oldukça nadirdir. Zehirli diğer bir tür, ciddi zehirlenme tablolarına yol açan karadul örümceğidir. Venomuna bağlı ciddi lokal ağrı, kas krampları, nörotoksisite, kardiyotoksisite, otonom bozukluklarla karekterize bu tabloya ‘Latrodectism’ adı verilir. Ülkemizden nadiren bildirilen vakalar mevcut olup, bazı yıllarda ve bölgelerde (Akdeniz Bölgesi) bildirim sıklığı artmaktadır. Tüm dünyada karadul toksisitesine rastlanmakla beraber, dünyanın belli bölgelerinde spesifik antivenomu vardır. Fakat tüm dünyada antivenoma erişimi kısıtlıdır. Ülkemizde antivenomu bulunmamaktadır.


5) Ülkemizde Mantar zehirlenmeleri
Tüm dünyada ve ülkemizde zehirlenmeye bağlı mortalitenin önemli nedenlerinden biri mantar zehirlenmeleridir. Ülkemizde mantar zehirlenmeleri ile ilgili çalışmalar incelendiğinde, genellikle tür bildirimlerinin olmadığı görülmektedir. Yıllık UZEM’e bildirilen yaklaşık 3500 civarı vaka mevcuttur. Karadeniz, Marmara, Akdeniz, Ege Bölgesi başta olmak üzere Türkiye’nin her bölgesi’nde görülmektedir. Mantar zehirlenmelerine bağlı akut karaciğer toksisitesinin görüldüğü vakalarda silibilin önerilmektedir. Literatür incelendiğinde mantar zehirlenmesine bağlı antidot kullanımı ile ilgili güçlü kanıt düzeyinde veri maalesef yoktur. N_asetil sistein ve Silibilin klasik kaynaklarda önerilmektedir. Zehirlenme hastalarında tedavi çoğunlukla vaka serisi bildirimlerine dayanır. Bu nedenle akut karaciğer toksisitesi gelişen bir hastada genel öneriler klasik toksikoloji kitaplarında silibilin kullanılması yönündedir. Yapılmış geniş vaka serili literatur analizlerine bakıldığında, amatoxin zehirlenmlerinde silibiline kullanılan ve kullanılmayan hastalarda anlamlı bir mortalite farkı olmadığını bildirilsede, bu çalışmaların hiçbiri randomize kontrollü çalışmalar değildir. Daha ağır toksisitelerde silibilline kullanımı tercih edildiği için, mortalite farkının olmaması bile anlamlı olabilir mi? sorusunu akla getirmektedir. Ülkemizde özellikle bölgesel mantar türlerinin bildirildiği yayınlara ihtiyaç vardır.
Sonuç olarak, zehirlenmeler genç erişkinlerde önemli bir ölüm nedenidir. Ülkemizde mortal sonuçlara neden olabilen zehirlenme etiyolojik ajanların riskli alanları belirlenerek, tedavi için hastane, il, bölge bazlı kaynaklara erken erişim değerlendirilmelidir. Aynı zamanda halkı bilgilendirecek eğitici faaliyetler (özellikle çok fazla kişiye ulaşımın sağlandığı medya aracılı bildirimler) kazara zehirlenmeleri azaltabilir.
KAYNAKLAR
Türkiye’nin Toksikolojik Haritası, TATD, 1-5 Aralık, 8. Avrasya Acil Tıp, 18. Türkiye Acil Tıp ve 17. WINFOCUS Dünya Kongresinde, Toksikoloji Paneli, Sunu Özeti.
Dünya uyuşurucu madde raporu 2022, https://www.unodc.org/unodc/en/data-and-analysis/world-drug-report-2022.html
Dünya uyuşturucu madde raporu 2021, https://www.unodc.org/unodc/en/data-and-analysis/wdr2021.html
Dünya uyuşturucu madde raporu 2020, https://wdr.unodc.org/wdr2020/en/index2020.html
Dünya uyuşturucu madde raporu 2019,
Türkiye uyuşturucu raporu 2022 https://www.narkotik.pol.tr/kurumlar/narkotik.pol.tr/TUB%C4%B0M/Ulusal%20Yay%C4%B1nlar/Turkiye-Uyusturucu-Raporu-2022.pdf
Narkolog 2022, Madde kullanıcıları profil analizi, http://www.narkotik.pol.tr/kurumlar/narkotik.pol.tr/TUB%C4%B0M/Ulusal%20Yay%C4%B1nlar/NARKOLOG-2022-MADDE-KULLANICILARI-PROFIL-ANALIZI.pdf
TURBAHAR, Türkiye Bağımlılık Risk Profili ve Ruh Sağlığı Haritası Proje Sonuç Raporu 2019, Hseyin Ünübol, Gökben Hızlı Sayar. https://uuyayinlari.com/turbahar-turkiye-bagimlilik-risk-profili-ve-ruh-sagligi-haritasi-proje-sonuc-raporu-2019
F Asicioglu , M Kuloglu Genc , T Tekin Bulbul , M Yayla , SZ Simsek, C Adioren, S Mercan, ∗ Investigation of temporal illicit drugs, alcohol and tobacco trends in Istanbul city: Wastewater analysis of 14 treatment plants. Water Research 190 (2021), 116729
Ulusal Zehir Danışma Merkezi (UZEM) Raporları 2014-2020, https://hsgm.saglik.gov.tr/depo/kurumsal/yayinlarimiz/Raporlar/Uzem/uzem_raporlari_2014-2020.pdf
Faysal Tekin, Ayça Açıkalın Akpınar, Ömer Taşkın, Ufuk Akday, N. Rana Dişel and Emre Karakoç. (2022) “Prospective analysis of intoxicated patients developing shock and/or organ failure,” Turkish Journal of Medical Sciences: Vol. 52: No. 5, Article 28. https://doi.org/10.55730/1300-0144.5508Availableat: https://journals.tubitak.gov.tr/medical/vol52/iss5/28
Valerie Romann,Monika Illgen, Adrian Derungs, Jolanta Klukowska-Rötzler, Meret E Ricklin,Aristomenis Exadaktylos ,Evangelia Liakoni.Presentations with reported methamphetamine use to an urban emergency department in Switzerland Swiss Med Wkly. 2021 Dec 28;151:w30099. doi: 10.4414/smw.2021.w30099. eCollection 2021 Dec 20.
Karadeniz H, Birincioglu I, Turna O, Ketenci HC, Beyhun NE. Fatal poisoning of chilhood in the Eastern Black Sea region of Turkey (2009-2013). .J Forensic Leg Med. 2015 Aug;34:109-12. doi: 10.1016/j.jflm.2015.06.001. Epub 2015 Jun 10.PMID: 26165668
Tugba Atmaca Temrel, Mortality rate associated with carbon monoxide poisoning in Turkey: A national database study (JPMA 71: 262; 2021), DOI: https://doi.org/10.47391/JPMA.637
Zengin S, Yılmaz M, Al B, Yildirim C, Yavuz E, Akcali A. Therapeutic red cell exchange for severe carbon monoxide poisoning. .J Clin Apher. 2013 Oct;28(5):337-40. doi: 10.1002/jca.21282. Epub 2013 Jun 8.PMID: 23749385
Demet Altun, Dilek Altun, Betül Ayaz. Yılan sokmalarında Klinik deneyimimiz. J Turk Soc Intensive Care 2016;14:100-4 DOI: 10.4274/tybdd.74046
Fatma ÜÇEŞ, Mehmet Zülfü YILDIZ. Snakes of Şanlıurfa Province. Commagene journal of biology 4(1): 36-61. DOI: 10.31594/commagene.725036
Abstract Book EACEM 2022, https://www.eacem.org/, Sevcan Seçinti, Ömer Taşkın, Ayça Açıkalın Akpınar, N. Rana Dişel, Zeynep Kekeç, Ahmet Sebe. Black widow spider toxicity in Turkey. A report of three cases.
Coexistence of Rhabdomyolysis, Myocarditis and Arrhythmia after Spider Bite: A Case Report. Yılmaz M, Akçay G, Gürses D.J Trop Pediatr. 2022 Apr 5;68(3):fmac027. doi: 10.1093/tropej/fmac027.
Erdur B, Turkcuer I, Bukiran A, Kuru O, Varol I.Uncommon cardiovascular manifestations after a Latrodectus bite.Am J Emerg Med. 2007 Feb;25(2):232-5. doi: 10.1016/j.ajem.2006.11.005
Ratsameekhae Jongthun, Pasin Hemachudha , Supaporn Wacharapluesadee , Thiravat Hemachudha Trop Doct Low-cost management of mushroom poisoning in a limited-resource area: a 12-year retrospective study 2020 Apr;50(2):135-138. doi: 10.1177/0049475519897704. Epub 2020 Jan 21.
Nurdan Acar, Mustafa Emin Çanakçı. Acil servise erken ve ge. Dönemde başvuran mantar zehirlenmesi olgularının değerlendirilmesi, 10 yıllık gözlemsel çalışma. Ankara Med J. 2020;(3):531-540
Serdar Özdemir1 İbrahim Altunok1 Abuzer Özkan1 Abdullah Algın1 Hatice Şeyma Akça1 Gökhan Aksel1 Serkan Emre Eroğlu. 1Effect of the COVID-19 Pandemic on Emergency Department Presentations with Mushroom Poisoning: A Report from Turkey. Avicenna J Med 2022;12:105–110
Lacombe G, St-Onge M. Towards evidence-based emergency medicine: best BETs from the Manchester Royal Infirmary. BET 1: Silibinin in suspected amatoxin-containing mushroom poisoning. Emerg Med J. 2016 Jan;33(1):76-7. doi: 10.1136/emermed-2015-205558.1.
.
Temel ve İleri Toksikoloji Kursumuz 17-18 Mart 2023 günlerinde Gaziantep Üniversitesi Şahinbey Araştırma ve Uygulama Hastanesinde gerçekleşecektir.
Kayıtlar tatdem üzerinden online olarak gerçekleştirilecektir.
Katılım için kayıt linkimiz: https://tatd.org.tr/tatdem/kurs/temel-ve-ileri-toksikoloji-kursu-17-18-mart-2023-gaziantep/
| 17 Mart 2023 CUMA | ||
| 08:30-09:00 | Açılış-Kurstan Beklentiler | |
| 09:00-09:40 | Toksikolojide Semptomatoloji ve Toksidromlar | Prof. Dr. Zeynep Kekeç |
| 09:40-10:20 | İnhalasyon Ajanları ile Zehirlenmeler (Karbonmonoksit Zehirlenmeleri, Siyanür) | Dr. Öğr. Üyesi Ersin Altınsoy |
| 10:20-10:40 | ARA | |
| 10:40-11:20 | Dekontaminasyon ve Antidotlar | Doç. Dr. Seyran BOZKURT |
| 11:20-12:00 | Ekstrakorporeal Tedaviler | Doç. Dr. Seyran BOZKURT |
| 12:00-13:00 | ÖĞLE YEMEĞİ ARASI | |
| 13:00-13:40 | Antideprasan Zehirlenmeleri | Doç. Dr. Müge Gülen |
| 13:40-14:20 | Cinsel Performans Artırıcı İlaçlar ve Karışımlar | Öğr. Üyesi Dr. Mustafa Sabak |
| 14:20-14:40 | ARA | |
| 14:40-15:20 | Tarım İlaçlarına Bağlı Zehirlenmeler | Prof. Dr. Ayça Açıkalın Akpınar |
| 15:20-16:00 | Parasetamol ve Nonsteroid Antiinflamatuar İlaç Zehirlenmeleri | Dr. Öğr. Gör. Akif Yarkaç |
| 16.00-16.20 | ARA | |
| 16.20-17.00 | Kimyasal Silahlar | Prof. Dr. Cuma Yıldırım |
| 18 Mart 2023 CUMARTESİ | ||
| 09:00-09:40 | Mantar Zehirlenmeleri | Prof. Dr. Suat Zengin |
| 09:40-10:20 | Sokak İlaçları ile Olan Zehirlenmeler | Doç. Dr. Rana Dişel |
| 10:20-10:40 | ARA | |
| 10:40-11:20 | Alkol Zehirlenmeleri | Doç. Dr. Müge Gülen |
| 11:20-12:00 | Venomu Olan Hayvanlara Bağlı Zehirlenmeler: Yılan Isırıkları, Akrep ve Örümcek Sokmaları | Prof. Dr. Ataman KÖSE |
| 12:00-13:00 | ÖĞLE YEMEĞİ ARASI | |
| 13:00-13:40 | Olgularla Toksikoloji | Prof. Dr. Cuma Yıldırım, Dr. Öğr. Üyesi Mustafa Sabak |
| 13:40-14:20 | Kalsiyum Kanal ve Beta Bloker Zehirlenmeleri | Prof. Dr. Ayça Açıkalın Akpınar |
| 14:20-14:40 | ARA | |
| 14:40-15:20 | Antipsikotik/Antikonvülzan İlaç Zehirlenmeleri | Doç. Dr. Erdal Yavuz |
| 15:20-16:00 | Söz Sizde | Tüm Eğitmenler |
| 16.00-16.30 | KAPANIŞ, SERTİFİKA TÖRENİ |
İletişim ve ulaşım için adres, telefon, e-posta
Adres: Gaziantep Üniversitesi Şahinbey Araştırma ve Uygulama Hastanesi, Üniversite Blv., 27310 Şehitkamil/Gaziantep
İletişim: Prof. Dr. Ataman Köse
+90 532 775 05 12
Prof. Dr. Cuma Yıldırım
+90 533 476 46 58
Diğer tüm detaylar için https://tatd.org.tr/toksikoloji/