Benzodiazepinler (BZD), hastalar tarafından en fazla yanlış kullanımı yapılan ve suistimal edilen ilaçlar arasında bulunmaktadırlar. BZD’ler tıbbi açıdan faydalı olmakla birlikte, potansiyel olarak tehlikelidirler. BZD’nin kötüye kullanımı, tolerans gelişimi, bağımlılık ve kısa-uzun vadeli yan etkilerindeki artışlar, BZD’lerin kesilmesini tıbbi olarak yönetmenin zorluklarını oluşturmaktadır.
Bu yazımızda Drug and Alcohol Dependence adlı dergide 2022 Mayıs ayında yayınlanan “A double-blind randomised crossover trial of low-dose flumazenil for benzodiazepine withdraw: A proof of concept”1 adlı yazıdan bahsedeceğim.
1. GİRİŞ
Benzodiazepinler, gamaaminobütirik asit (GABA) sistemi (öncelikle GABAA reseptörü) üzerinde etki ederek, GABA varlığında klorür kanalının açılma frekansını arttırarak hiperpolarizasyona neden olan bir ilaç sınıfıdır. Bu öncelikli olarak bir anksiyolitik, yatıştırıcı ve antikonvülsan etki ile sonuçlanır; bununla birlikte, bu ilaçların endikasyonları anksiyete semptomlarının yönetiminden kas gevşemesine kadar uzanır.
1960 yılında ilk BZD olan klordiazepoksitin piyasaya sürülmesinden bu yana birçok türev sentezlenmiş ve pazarlanmıştır: bunlardan en çok bilinenleri kuşkusuz diazepam ve alprazolam’dır.
Barbitüratlara göre geliştirilmiş güvenlik profilleri nedeniyle, klinik pratikte kullanımları önemli ölçüde artmıştır; bununla birlikte, BZD’lere toleransın ortaya çıkması ve BZD’lerden geri çekilme semptomlarının gözükmesi klinik bir ikilem ortaya koymuş ve o zamandan bu yana bu ilaçların yönetilmesini zorlaştırmıştır.
BZD türevi ilaçları azaltmak endike olduğunda bunu yapmak için literatürde önerilen birden çok yöntem vardır. Bunlar, “aniden kesme,” “haftalık %25 doz azaltma”, “her iki haftada bir günlük dozun sekizde biri ila onda biri oranında azaltma” ve “semptom rehberli geri çekilmeyi” içerir. Bununla birlikte, yavaş doz azaltımı ile bile, bazı hastalar anksiyete, ajitasyon ve huzursuzluk, duygu durum dalgalanmaları, uykusuzluk, hafıza bozukluğu, bulantı ve kusma, taşikardi ve ciddi vakalarda nöbetler gibi yoksunluk semptomları bildirilmektedir. Bırakmanın şiddetini ve süresini muhtemelen etkileyen üç faktör şunlardır: ilacı kullanım süresi, ilacın dozu ve ilacın yarı ömrü (kısa yarı ömür, yoksunluk sendromunu kötüleştirir).
Bugüne kadar BZD çekilmesi sırasında hastaların iyilik halini arttırabilmek adına çeşitli ilaçlar klinik deneylere konu olmuştur. BZD doz aşımında ya da girişimsel bir işlem sırasında oluşturulan sedasyonun tersine çevrilmesi için kullanılan bir GABAA reseptör antagonisti olan Flumazenil, birkaç randomize kontrol çalışmada araştırılmıştır. Çalışmalar, genellikle değişken dozlarda (1-4 mg/24 saat) etkinlik değerlendirmesi yapılmakla beraber; bilindiği kadarıyla, katı bir azaltma protokolü izlenmeden flumazenilin BZD kullanımını azaltmadaki etkinliğini değerlendiren bir çalışma yoktur.
Harrison ve arkadaşlarının çalışmasında Flumazenilin düşük dozda sürekli infüzyon şeklinde uygulanması bolus şeklinde verilmesine göre daha güvenli olduğu gösterilmiştir fakat katılımcılara 30 saniyede uygulanan 1 mg flumazenil dramatik panik reaksiyonları ve ardından BZD yoksunluk semptomlarını hızlandırdığı görülmüştür. Bununla birlikte, BZD kullanımını azaltma girişimleri, flumazenil grubunda daha başarılı olmuştur. Flumazenilin (0,4-0,5 mg) 20-25 dakikadan daha yavaş uygulanmasının bile BZD kullanıcılarında paniği hızlandırdığı gösterilmiştir.
Bu çalışmanın amacı, 30 mg’lık terapötik maksimum diazepam eşdeğerinin üzerinde ve altında alan katılımcılarda BZD kullanımını, yoksunluk semptomlarını ve kullanım isteğini azaltmak için düşük doz subkutan flumazenilin güvenliği ve etkinliği hakkında pilot veri toplamak ve gelecekteki çalışmalar için örneklem büyüklüğü hakkında bilgi vermek olarak belirlenmiştir.
2. METODOLOJİ
2.1. Klinik Koşullar
Çalışma, Currumbin Clinic (Currumbin, Queensland) ve Fresh Start Recovery Program’ında (Subiaco, Batı Avustralya) hem yatarak hem de ayakta tedavi gören hastaları içeren, çok bölgeli, çift kör, randomize çapraz geçişli bir şekilde tasarlanarak yürütülmüş.
2.2.Katılımcılar
Katılımcılar hem yatarak tedavi gören hem de ayaktan tedavi gören hastalar olmak üzere iki gruptan alınmış. Yatan hastalar, deneme süresi boyunca klinik personeli tarafından izlenirken, ayakta tedavi gören hastalar ise atanmış bir bakıcının gözetimi altında takip edilmiş.
Çalışmaya; deneme süresi boyunca BZD kullanımlarını azaltmak amacıyla, günlük BZD kullanım öyküsü olan 28 katılımcı çalışmaya dahil edilmiş.
Dahil etme kriterleri, üç aydan uzun süredir günlük BZD kullanımı, günlük 10 mg diazepam eşdeğerinden daha fazla günlük BZD kullanımı ve BZD’leri bırakma arzusu olarak belirlenmiş.
Dışlama kriterleri ise flumazenilin nöbeti hızlandırma olasılığı nedeniyle epilepsi veya nöbet öyküsü, şu anda hamile olma veya emzirme ve 18 yaşın altında olunması olarak belirlenmiş.
28 katılımcıdan her gruptan bir tane olmak üzere toplam iki katılımcı çalışmanın dahil etme kriterlerini ihlal etmeleri nedeniyle çalışmadan çıkarılmış.
2.3.Çalışma Tasarımı
Çalışma çift kör, randomize çapraz geçişli olarak tasarlanmış. Tüm katılımcılar, çalışma süresi boyunca ilk olarak flumazenil veya plasebo alacak şekilde randomize edilmiş. 8 gün sonrasında da çapraz geçiş sağlanmış. Katılımcılar maksimum günlük doz olmaksızın gerektiğinde 10 mg’a kadar diazepam talep etmekte özgür tutulmuş. Diazepam talep ettiklerinde, katılımcıların, değiştirilmiş bir Klinik Enstitü Geri Çekilme Değerlendirme Ölçeğine-Benzodizepin (CIWA-B) göre değerlendirilmeleri yapılmış. Bu değerlendirmede, konsantre olma güçlüğü, hızlı kalp atışı, iştahsızlık, kaygı, baş ağrıları ve gözlemlenebilirliği değerlendiren altı maddeden toplam iki veya daha fazla puan aldıklarında ilaç almalarına izin verilmiş.
Flumazenil ilk grubu, çalışmanın birinci gününde flumazenil alarak başlamış ve 9. Günde plaseboya geçilmiş. Plasebo ilk grubu ise, ilk 8 gün boyunca plasebo infüzyonu almış ve sonrasında 9. Günden itibaren flumazenil infüzyonuna geçilmiş (Şekil 1).

Şekil 1. Her iki tedavi grubu için zaman çizelgesi
2.4.Sonlanım Ölçümleri ve Değerlendirmeler
Sonlanım hedefleri, (1) diazepam ve diğer BZD kullanımı için başlangıca göre yüzdesel azalma, (2) BZD yoksunluk skorunda başlangıca göre yüzdesel azalma, (3) BZD kullanma isteği skorunda başlangıca göre yüzdesel azalma, (4) tedaviyle ilgili advers olaylar (AO), (5) plasebo birinci grupta BZD kullanımındaki değişiklikler olarak 5 başlık altına toplanmış.
Bu Sonlanımlar;
(1,5) deneme süresi boyunca herhangi bir yasadışı BZD kullanımını hesaba katan diazepam kayıt sayfası ve takip raporu formu kullanılarak ölçülmüş
(2) Yoksunluk belirtilerini hafif (1-20), orta (21-40), şiddetli (41 —60) ve çok şiddetli (61 —80) olarak CIWA-B’a göre sınıflandırılmış
(3) Kısa Madde kullanma isteği Ölçeği
(4) AO rapor formları ile belirlenmiş.
2. ile 7. günler ve 10. gün ile 15. gün arasında BZD kullanımları kaydedilmiş (Plasebo veya flumazenil infüzyon başlangıç ve bitiş saatlerinde az da olsa varyasyon olduğu için infüzyon başlanan ve bitirilen günler değerlendirilmeye alınmamış ilk ölçümler başlangıçtan sonraki gün saat 08.00’de yapılmış). İnfüzyon başlangıç ve bitiş günlerinde (1., 4., 8., 9., 12., 16.) ise çekilme, BZD kullanma isteği ve yasadışı BZD kullanımı kaydı yapılmış. OE’ler tüm katılımcılar için oluştuğu gibi rapor edilmiş Çalışmanın birincil amacı, başlangıçta <30 mg ve> 30 mg diazepam eşdeğeri alan katılımcılarda flumazenilin detoksifikasyon sırasında BZD kullanımını azaltıp azaltmayacağını belirlemekmiş. İkincil hedefler, katılımcıları iki gruba ayırdıktan sonra yoksunluk belirtileri ve BZD isteklerindeki değişiklikleri araştırmak ve bu, türünün ilk çalışma tasarımı olduğundan, güç ve örneklem büyüklüğü hesaplamaları için birincil sonucun etki büyüklüğünü belirlemekmiş.
2.5. Benzodiozepin dozu
Günlük BZD dozu, katılımcının almakta olduğu ana BZD’ye göre başlangıçta hesaplanmış. Dozaj, Güney Avustralya Benzodiazepin eşdeğerleri tablosuna dayalı olarak günlük diazepam eşdeğerine dönüştürülerek belirlenmiş. Dönüşüm kılavuzu, 5 mg diazepamın 0,5 mg alprazolam, 0,25 mg klonazepam, 1 mg lorazepam, 30 mg oksazepam, 10 mg temazepam, 10 mg zolpidem ve 7,5 mg zopiklona eşdeğer olduğunu kabul etmektedir.
Katılımcılar günlük kullandıkları benzodiazepin dozuna göre <30 mg (düşük doz) ve ≥ 30 mg (yüksek doz) olarak ikiye ayrılmış.
2.6. Prosedür
Tüm katılımcılara, Go Medical Industries tarafından üretilen SpringFusor pompası kullanılarak subkütan olarak verilen 16 günlük bir süre boyunca çapraz tasarımlı iki flumazenil ve iki salin infüzyonu verilmiş. SpringFusor kullanımı ve katılımcıların infüzyon süresince hareketli olmasına olanak sağlayan bir düzeneğe sahipmiş. Her bir infüzyon daha önceki çalışmaları örnek alarak 24 saatte 4 mg (± %20) verecek ve 96 saat sürecek şekilde tasarlandı. Tedavi periyodu sırasında, katılımcılar, günlük ihtiyaçlarına göre tek seferde 10 mg’a kadar olmak üzere diazepam talep edebilmişler. Bu katılımcılar modifiye CIWA-B’de iki veya daha fazla puan alırlarsa ilaç istekleri karşılanmış ve günlük maksimum doz sınırlaması belirlenmemiş. Tüm personel ve bakıcılar, değiştirilmiş CIWA-B’yi uygulayacağı konusunda eğitilmiş. Yatan hastanın diazepamı, eğitimli klinik personeli tarafından uygulanmış ve kaydedilmiş. Ayaktan hastaların diazepam kullanımı, eğitimli seçilmiş bakıcı tarafından uygulanmış ve kaydedilmiş. Kalan diazepam, doğruluk ve kaydedilmemiş yanlış kullanımı belirlemek için kullanılan miktarla çapraz olarak kontrol edilmiş. Çalışma boyunca, katılımcılar, kendi rutin olarak kullandıkları ilaçlarını (BZD’ler hariç) kullanmaya devam etmiş ve diğer ilaçlarda klinik ihtiyaca göre değişiklikler yapılmış. Katılımcılar halihazırda anti-epileptik ilaç kullanmıyorsa, infüzyon süresince günde üç kez 100 mg fenitoin uygulanmış.
2.7. Randomizasyon
Randomizasyon bilgisayar tarafından yapılmış ve dağılım 1:1 olarak belirlenmiş. Klinik ve araştırma personelinin, çalışma süresi boyunca kimin hangi ilacına aldığına karşı bilgisi yokmuş.
3. SONUÇLAR
Katılımcı karakteristikleri
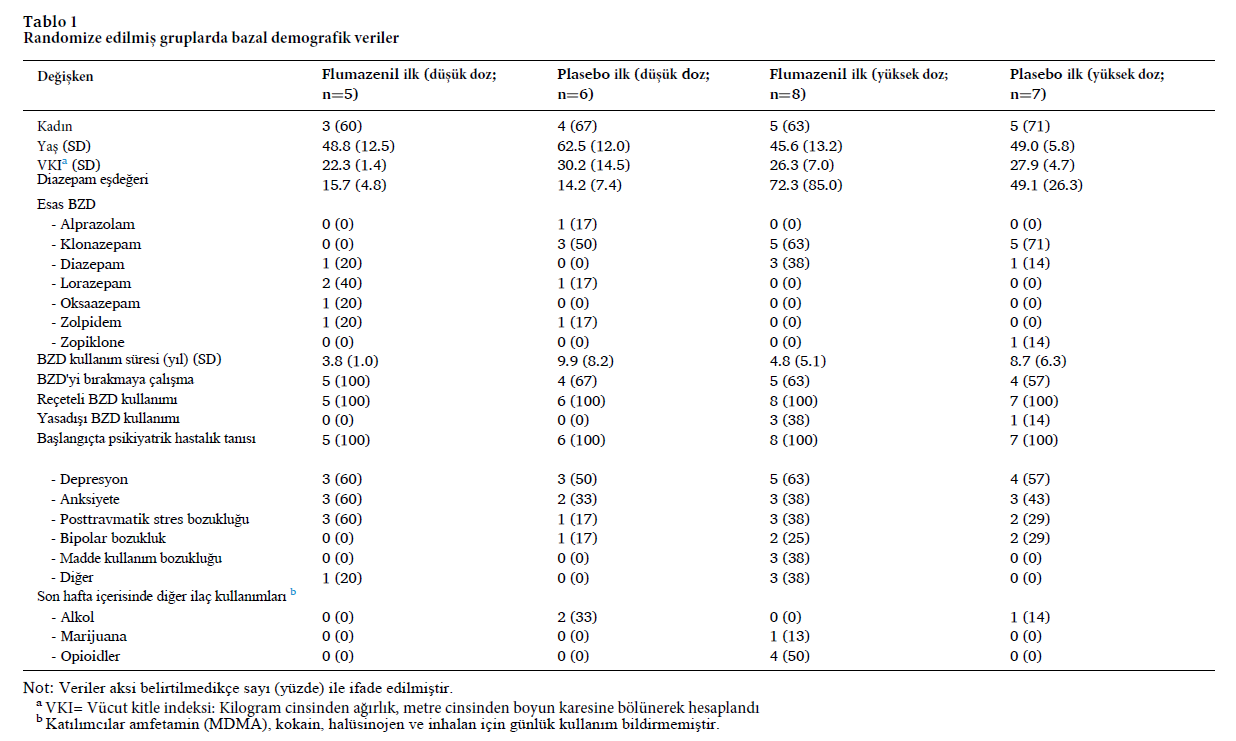
Flumazenil ilk grubunda düşük doz (n = 5) ve yüksek doz (n = 8) ve plasebo ilk grubunda düşük doz (n = 6) ve yüksek doz (n = 7) katılımcılarının temel özellikleri Tablo 1’de gösterilmiştir.
Ortalama yaş ve benzodiazepin kullanım süresindeki farklılıkların en çok düşük doz grupları arasında belirgin olduğu görülse de bu farklılıkların istatistiksel olarak anlamlı olmadığı bulunmuş. Yüksek doz kohortundaki farklılıklar, büyük ölçüde, flumazenil ilk grubunda başlangıçta 280 mg diazepam eşdeğeri kullanan tek bir katılımcıdan kaynaklanmış. Flumazenil ilk yüksek doz grubu için günlük diazepam eşdeğeri kullanım 30 mg ila 280 mg arasında değişirken, plasebo ilk yüksek doz grubu 30 mg ila 100 mg arasında değişmekteymiş. İlk flumazenil (40 mg) ve ilk plasebo (34 mg) gruplarında medyan başlangıç diazepam eşdeğeri kullanımının benzer olduğu görülmüş. Katılımcıların çoğu BZD kullanımını engellemeye çalışmış fakat başarısız olmuştur. Hiçbir katılımcı yasa dışı BZD kullanımı yoktu ve hepsine daha önce bir psikiyatrik durum teşhisi konmuştu. En yaygın olanı depresyon ve anksiyete bozukluklarıydı.
Günlük olarak düşük doz diazepam (<30 mg) kullanan grupta bazale göre diazepam kullanımındaki değişim, bazale göre çekilmedeki değişim ve bazale göre BZD arzulamadaki değişim açısından iki grup arasında anlamlı fark bulunmamış (p=0.429, 0.556, 0.476, sırasıyla) (Tablo 2).
Günlük olarak yüksek doz diazepam (≥ 30 mg) kullanan grupta bazale göre diazepam kullanımı değişimi Welch’in t testi ile karşılaştırılmış. İstatistiksel olarak flumazenil ilk grubu (M= -75.30, SD=11.43), plasebo ilk grubuna (M=-44.85, SD=26.87), t(8.10) = -2.76, p=0.024, çift taraflı, Hedge’nin g’si=-1.38) kıyasla benzodiazepin kullanımında daha fazla azalma göstermiş (%30.5, %95 GA [-54.85, -5.10] (Tablo 3).
Günlük olarak yüksek doz diazepam (≥ 30 mg) kullanan grupta , bazale göre çekilmedeki değişim ve bazale göre BZD arzulamadaki değişim açısından iki grup arasında anlamlı fark bulunmamış (p=0.836, 0.908, sırasıyla) (Tablo 3).

Çalışmanın güç analizi değerlendirildiğinde çalışmanın gücü %61 (underpowered) olarak değerlendirilmiş ve ilerideki çalışmaların %80 güce ulaşması için grupların 20’şer kişi olması gerektiği önerilmiş.
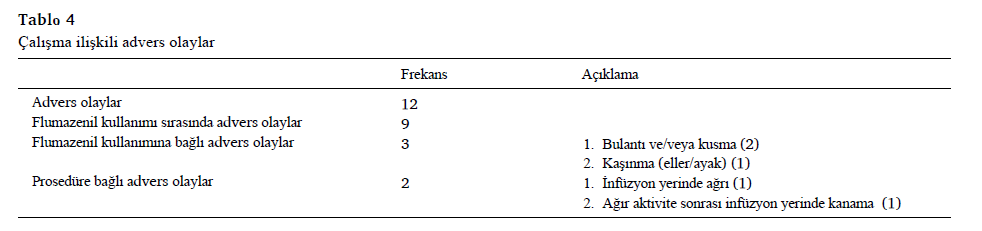
Çalışmayla ilgili advers olaylar
Deneme sırasında ciddi bir advers olay kriterlerini karşılamayan toplamda 12 AO kaydedilmiş. 12 AO’dan dokuzu flumazenil tedavisi sırasında meydana gelmiş (Tablo 4). Bunlardan üç AO’ın flumazenil ile ilişkili olduğu ve ikisinin de prosedürle ilgili olduğu belirlenmiş. Plasebo ile tedavi sırasında üç AO meydana gelmiş veikisi tedaviyle ilgili değilmiş ve biri belirsizmiş.
4.TARTIŞMA
Bilindiği kadarıyla bu çalışma, sıkı bir doz azaltma rejimine bağlı kalmadan flumazenil alan katılımcılarda BZD kullanımını değerlendiren ilk randomize kontrol çalışmadır. Sonuçlar, flumazenilin maksimum terapötik günlük diazepam dozu eşdeğeri (30 mg) veya daha fazlasını alan katılımcılarda kendi kendine talep edilen BZD kullanımını önemli ölçüde azalttığını göstermiş. Bu bulgu, bazalde günlük 30 mg’dan az diazepam eşdeğeri alanlarda görülmedi, bu da tedaviden önce 30 mg eşdeğeri diazepam alanlarda flumazenilin diazepam kullanımını azaltmada daha az değerli olduğunu düşündürmektedir. Her iki grupta da yoksunluk veya kullanım isteği puanlarında anlamlı bir fark görülmedi.
Önceki randomize kontrollü çalışmalarda diazepam kullanım değerleri çalışmalar arasında değişiklik göstermiştir: Gerra ve arkadaşlarının 2002’deki çalışmasında2; 15-90 mg, Gerra ve arkadaşlarının 1993’teki çalışmasında3 40-60 mg, Saxon ve arkadaşlarının 1997’deki çalışmasında4 7.5-125 mg. Bu çalışmalarda, %12 (n = 6/50), %0 (n = 0/36) ve %20 (n = 2/10), terapötik aralığın (30 mg) altında diazepam eşdeğer dozları kullanmıştır. Ayrıca, flumazenilin etkinliğini değerlendiren randomize olmayan kontrollü çalışmalarda katılımcıların çoğu veya tamamı terapötik doz aralığını aşmıştır. Çalışmalar, grup olarak geri çekilme puanlarında düşüşler gösterdi; ancak düşük doz BZD kullanan katılımcılar yeterince temsil edilmediği düşünülmektedir. Bu nedenle, bu popülasyonda yoksunluk semptomlarını hafifletmek için flumazenilin etkinliğini ölçmenin zor olduğu düşünülmüş. Bu nedenle bu çalışma, terapötik aralığın altında diazepam eşdeğer dozları kullanan katılımcıların %42’si ile farklı bir demografiyi değerlendirmiştir. Bu çalışmanın bulguları küçük bir örneklem büyüklüğü ile sınırlıydı ve gelecekte, değişen BZD kullanıcılarında flumazenilin etkinliğini daha fazla araştırmak için daha büyük bir randomize kontrollü çalışma yürütülmelidir.
5.KISITLILIKLAR
Çalışma, gelecekteki çalışmalar için örneklem büyüklüğü hakkında bilgi vermeyi amaçlayan bir pilot çalışma olsa da, çalışmanın düşük gücü tip II hatalara (yanlış negatif) yol açabileceğinden, bulgular dikkatle yorumlanmalıdır. Ayrıca, çalışma sırasında benzodiazepin kullanımı idrar tahlili ile doğrulanmadı ve yasa dışı benzodiazepin kullanımı sadece katılımcıların kendi bildirimiyle belirlendi, bu nedenle nesnel ölçümlerin eksikliği yoluyla öz bildirim yanlılığı ortaya çıktı. Gelecekteki araştırmalar, flumazenilin etkili olabileceği bir popülasyonu tanımlamak için hafif, orta ve şiddetli yoksunluk semptomları olanlarda olduğu kadar, terapötik aralığın üstünde ve altında günlük diazepam eşdeğerlerini kullanan katılımcılarda flumazenilin etkinliğini değerlendirmelidir. Düşük doz BZD kullanıcılarında diazepam kullanımı, yoksunluk ve kullanım isteği skorlarındaki değişimler yeterince güce sahip randomize kontrollü çalışmalarla değerlendirilmelidir. Ayrıca, bu çalışma yatarak veya ayakta tedavi gören katılımcıların pratikliğine izin verirken, gelecekteki çalışmalar, klinik olarak denetlenen bir detoks ünitesi gibi daha kontrollü bir ortamda tekrarlanabilir ve doz azaltma gibi alternatif yoksunluk yöntemleriyle karşılaştırılabilir.
6. SONUÇLAR
Veriler, düşük doz flumazenilin, tedaviden önce en az üç ay süreyle terapötik aralıkta (>30 mg diazepam eşdeğeri) ve üzerindeki dozlarda BZD kullanan bireylerde diazepam kullanımını azalttığını göstermektedir. Düşük doz BZD (<30 mg diazepam) alan katılımcılarda flumazenilin etkinliği gösterilememiş olsa da bu çalışmanın pilot bir çalışma olduğu ve gücünün (%61) bunu göstermeye yetersiz olabileceği akılda tutularak sonuçlar dikkatle yorumlanmalıdır.
KAYNAKLAR
- MacDonald T, Gallo A, Basso-Hulse G, Bennett K, Hulse G. A double-blind randomised crossover trial of low-dose flumazenil for benzodiazepine withdrawal: A proof of concept. Drug Alcohol Depend. 2022:109501.
- Gerra G, Zaimovic A, Giusti F, Moi G, Brewer C. Intravenous flumazenil versus oxazepam tapering in the treatment of benzodiazepine withdrawal: a randomized, placebo‐controlled study. Addict Biol. 2002;7(4):385-395.
- Gerra G, Marcato A, Caccavari R, et al. Effectiveness of flumazenil (RO 15-1788) in the treatment of benzodiazepine withdrawal. Current therapeutic research. 1993;54(5):580-587.
- Saxon L, Hjemdahl P, Hiltunen A, Borg S. Effects of flumazenil in the treatment of benzodiazepine withdrawal–a double-blind pilot study. Psychopharmacology (Berl). 1997;131(2):153-160.

