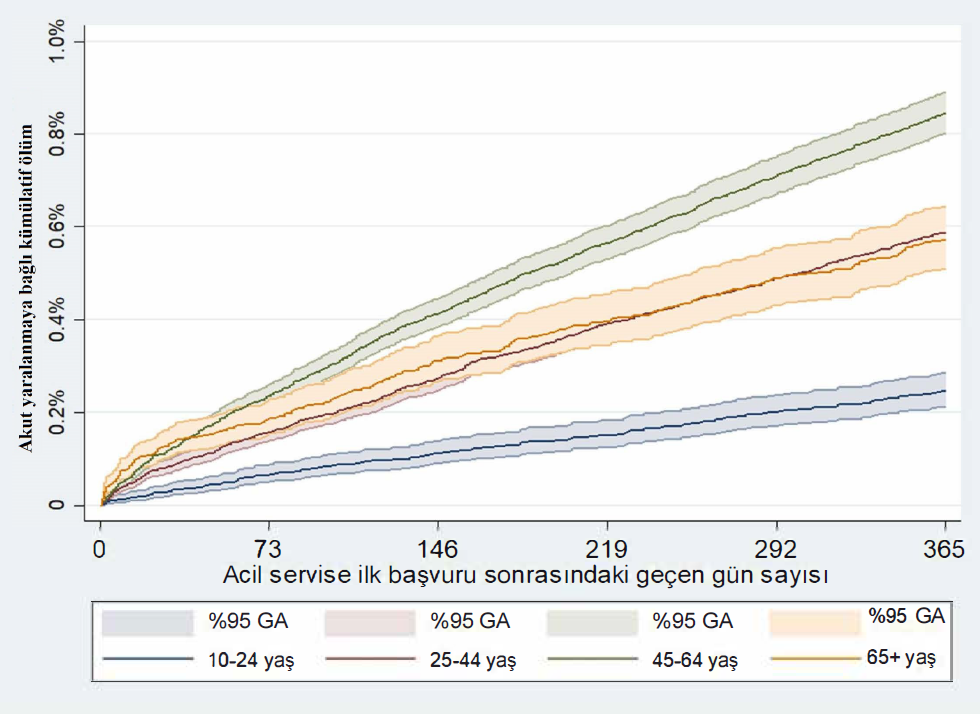
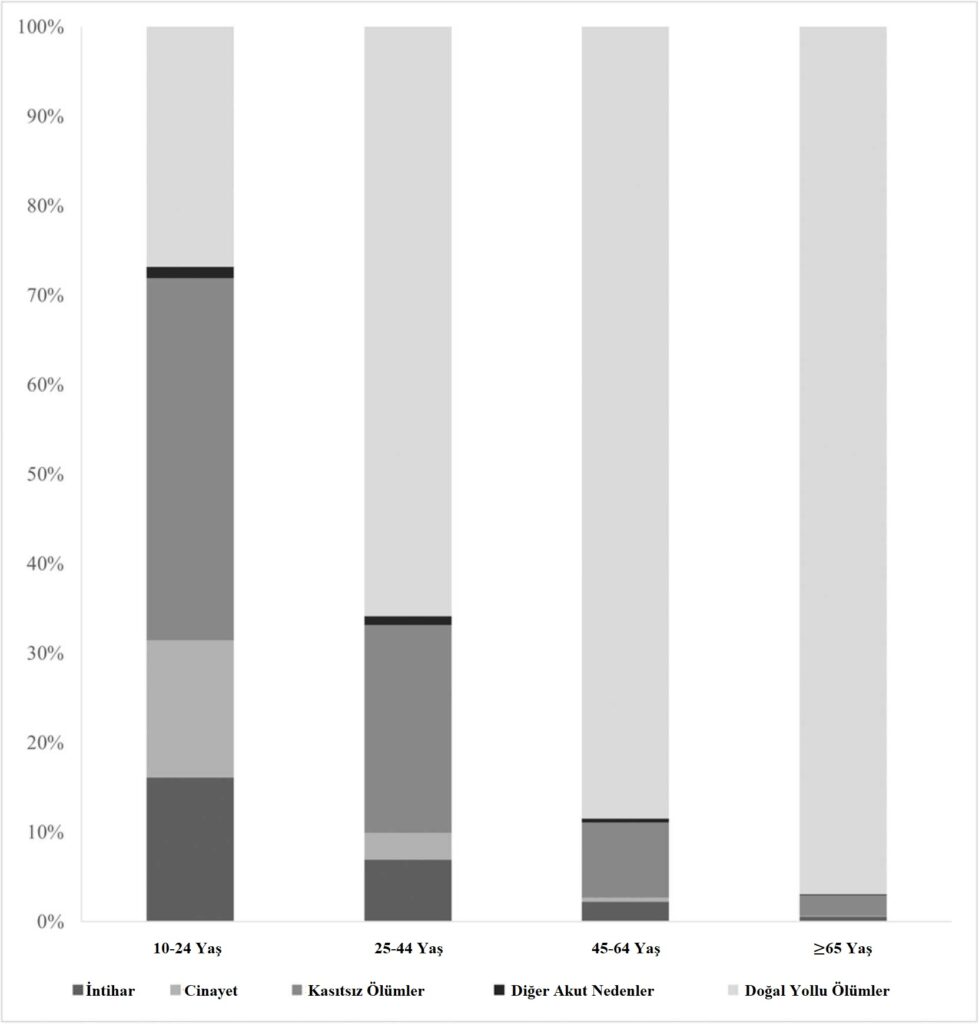
Dünyamızda son yüzyılda nüfus artışının hızlanmasıyla birlikte birçok hastalık ve bu hastalıklara bağlı ilaç kullanımında artış olmuştur. Sağlığın genel tanımında da olduğu gibi bu hastalıklar ruhen, bedenen ve sosyal yönden olabilmektedir. Enfeksiyon korkusu, işsizlik korkusu, evden çalışma, çocuklarda evden eğitim, aile ve sosyal çevreyle iletişim eksikliği psikiyatrik hastalık riskini ve psikiyatrik ilaçların kullanımını son yıllarda arttırmıştır. Antidepresan ve antipsikotik ilaç kullanımı ilişkili hepatotoksisite hakkında yazdığım yazımla herkesi selamlıyor ve saygılarımı iletiyorum.
Giriş
İlaca bağlı karaciğer hasarı (DILI-Drug Induced Liver Injury), kalıcı karaciğer fonksiyon kaybı ve ölüme yol açabilecek; ilaçlar ve metabolitlerine karşı oluşan bir reaksiyondur. DILI, geniş bir klinik yelpazeye sahiptir. Bu yelpaze karaciğer fonksiyon testlerinde asemptomatik anormalliklerden; semptomatik akut karaciğer hastalığı, uzun süreli sarılık ve karaciğer yetmezliğine kadar uzanmaktadır.1 Hepatotoksisite, karaciğerde steatoz, steatohepatit, fibrozis, siroz olarak sonuçlanabilir. Pek çok psikiyatrik hastalığın tedavisinde kullanılan antidepresan ve antipsikotikler terapötik dozda olsa dahi hepatotoksisitede rol oynayabilir.2 160’tan fazla psikiyatrik ilacın hepatotoksik yan etkisi olduğu gösterilmiştir. 185 hasta ile yapılan bir kohort çalışmada DILI vakalarının %7,6’sından psikiyatrik ilaç kullanımı sorumludur. Risk faktörü (alkolizm, madde bağımlılığı, çoklu ilaç kullanımı, obezite, DM) olan hastalarda psikiyatrik ilaç kullanımında karaciğer toksisitesi açısından dikkatli olunmalıdır.3
Psikotrop İlaçların Hepatik Metabolizması
Psikotrop ilaçların metabolizması esas olarak karaciğerde meydana gelir ve sitokrom P450’ye bağlı monooksijenaz (CYP) izoform ailesi en önemli ilaç metabolize edici enzimlerdir. Sitokrom P450, ksenobiyotikleri, steroidleri, yağ asitlerini ve vitaminleri metabolize eden monooksidazların bir üst ailesidir. Sitokrom P450 enzimlerinin substratı olan ilaçların dozdan bağımsız bir şekilde DILI’ye neden olma olasılığının daha yüksek olduğu, CYP450 inhibitörü olan ilaçların ise yalnızca yüksek günlük dozlarda uygulandıklarında DILI olasılığının daha yüksek olduğu gözlenmiştir. Antidepresanların ve antipsikotiklerin çoğu, CYP450 süper ailesi izoenzimlerinin substratlarıdır.2
Antidepresan İlaçlar ve Hepatotoksisite
Antidepresanların öncü sınıfları olan monoamin oksidaz inhibitörleri (MAOİ) ve trisiklik antidepresanlar (TCA) 1950’lerde klinik olarak kullanılmaya başlandı. MAOİ’ler ve TCA’lar genellikle karaciğer toksisitesi ile ilişkilidir; ancak günümüzde mevcut kullanımları seyrek olduğundan, bu vakaların çoğu 1980’lerde ve 1990’larda rapor edilmiştir. 1990’ların sonlarında, MAOİ’ler ve TCA’ların yerini büyük ölçüde daha güvenli ve daha iyi tolere edilen yeni nesil antidepresanlar almıştır: seçici seratonin geri alım inhibitörleri (SSRI), seratonin ve norepinefrin geri alım inhibitörleri (SNRI) ve seratonin antagonisti ve geri alım inhibitörleri (SARI).2 Fluoksetin, paroksetin, sertralin, sitalopram ve fluvoksamin çoğunlukla hepatotoksisite ile bağlantılı SSRI’lardır. SNRI grubundan venlafaksin ve duloksetinin yanı sıra SARI grubundan trazodon da hepatotoksik yan etkilerle güçlü bir şekilde ilişkilidir (Tablo 1).4,5
Tablo-1: Antidepresan ilaçlar için hayvan çalışmalarında bildirilen lezyon tipleri ve şüphelenilen mekanizmanın yanı sıra hepatik etkiye sahip DILI vakaları2
| ANTİDEPRESAN İLAÇLAR | SINIF | LEZYON TİPİ (VAKA ANALİZİ) | İLGİLİ MEKANİZMA | KARACİĞER ETKİLERİ (HAYVAN ÇALIŞMALARI) |
| FENELZİN | MAOI |
Ciddi hepatit ve kolestatik lezyonlar Hepatik Anjiosarkoma
|
Metabolik ve genetik Bilinmiyor |
Lipid birikimini azaltmak
|
| İMİPRAMİN | TCA |
Kolestazis ve fibrozis Toksik Hepatit Subfulminan hepatik yetmezlik
|
Bilinmiyor Toksik etki veya hipersensitivite reaksiyonu Toksik etki veya hipersensitivite reaksiyonu
|
Pro-oksidan
|
| AMİTİRPTİLİN | TCA |
Fulminan hepatit Sentrilobüler kolestazis Akut hepatit
|
İmmüno alerjik mekanizma İmmüno alerjik mekanizma Bilinmiyor |
Pro-oksidan Steatojenik Steatojenik |
| TİANEPTİN | TCA | Akut hepatit |
İmmüno alerjik mekanizma
|
Steatojenik |
| FLUOKSETİN | SSRI |
Akut hepatit Akut hepatit Kolestatik hepatit Steatohepatit
|
Bilinmiyor Metabolik idiosenktorik reaksiyon İmmünolojik mekanizma İdiosenkrotik mekanizma |
Steatojenik Pro-oksidan Pro-oksidan Steatojenik
|
| PAROKSETİN | SSRI |
Transaminitis Kolestatik ve hepatosellüler hasar Ciddi akut hepatit
|
İdiosenkrotik mekanizma İmmünite ilişkili hipersensitivite reaksiyonu İdiosenkrotik mekanizma
|
–
|
| SERTRALİN | SSRI |
Akut fatal hepatit Akut hepatosellüler hasar
|
İmmüno alerjik mekanizma İdiosenkrotik mekanizma
|
Pro-oksidan Proinflamatuar |
| SİTALOPRAM | SSRI |
Kolestazis Akut hepatik hasar |
Bilinmiyor Bilinmiyor
|
Pro-oksidan Pro-inflamatuar |
| FLUVOKSAMİN | SSRI |
Kolestazis ve hepatolizis
|
Bilinmiyor | Steatojenik |
| VENLAFASKİN | SNRI |
Akut hepatit Fulminan hepatik yetmezlik Kolestatik hepatit
|
İdiosenkrotik mekanizma Bilinmiyor İdiosenkrotik mekanizma
|
Pro-inflamatuar |
| DULOKSETİN | SNRI |
Fulminan hepatik yetmezlik Hepatoselüler ve kolestatik yetmezlik Akut hepatik yetmezlik
|
Bilinmiyor İdiosenkrotik mekanizma Bilinmiyor |
Pro-oksidan |
| TRAZADON | SARI |
Transaminitis Akut hepatik yetmezlik ve kolestazis Akut karaciğer yetmezliği
|
İdiosenkrotik mekanizma Bilinmiyor İdiosenkrotik mekanizma
|
– |
Antipsikotik İlaçlar ve Hepatotoksisite
Klorpromazin ve haloperidol gibi yaygın olarak reçete edilen birinci kuşak antipsikotikler, sıklıkla karaciğer enzimlerinin serum seviyelerinin yükselmesine ve ayrıca ciddi karaciğer hasarına neden olmuştur. Klozapin, risperidon, olanzapin ve ketiapin dahil ikinci kuşak antipsikotikler, 1990’lardan beri mevcuttur. Sunulan veriler hem birinci kuşak antipsikotiklerin hem de ikinci kuşak antipsikotiklerin hepatotoksisite riski ile ilişkili olduğunu göstermektedir. Klorpromazin, klozapin ve ketiapin için yaşamı tehdit eden veya şiddetli DILI bildirilmiştir (Tablo 2).
Tablo-2: Antipsikotik ilaçlar için hayvan çalışmalarında bildirilen lezyon tipi ve şüphelenilen mekanizmanın yanı sıra hepatik etkiye sahip DILI vakaları2
| ANTİPSİKOTİK İLAÇLAR | SINIF | LEZYON TİPİ (VAKA ANALİZİ) | İLGİLİ MEKANİZMA | KARACİĞER ETKİLERİ (HAYVAN ÇALIŞMALARI) |
| KLORPROMAZİN | Birinci Kuşak Antipsikotik |
Kronik Sarılık Hepatoselüler Kolestazis Biliyer Siroz Kolestazis
|
Bilinmiyor Bilinmiyor Bilinmiyor İdiopatik
|
Steatojenik Pro-oksidan Steatojenik –
|
| HALOPERİDOL | Birinci Kuşak Antipsikotik | Hepatoselüler hasar ve Kolestazis
Sitolitik Hepatit Akut Transaminitis |
Bilinmiyor
Bilinmiyor Bilinmiyor |
Pro-oksidan Pro-oksidan Pro-oksidan; pro-inflamatuar
|
| KLOZAPİN | İkinci Kuşak Antipsikotik |
Asemptomatik Transaminitis Fatal Fulminan Hepatik Yetmezlik Hepatit Transaminitis
|
Metabolik veya immünoalerjik Bilinmiyor İdiosenkrotik mekanizma İdiosenkrotik mekanizma
|
Pro-oksidan; pro-inflamatuar Pro-oksidan Steatojenik Steatojenik
|
| RİSPERİDON | İkinci Kuşak Antipsikotik | Kolestatik Hepatit
Steatohepatit Sitolitik Hepatit Kolestazis Transaminits |
İmmünoalerjik reaksiyon Bilinmiyor İmmünoalerjik reaksiyon Bilinmiyor İmmünoalerjik reaksiyon
|
Steatojenik Steatojenik Steatojenik Pro-oksidan Steatojenik
|
| OLANZAPİN | İkinci Kuşak Antipsikotik | Akut Hepatoselüler-Kolestatik
Transaminits Kolestazis Sitolitik Hepatit Dislipidemi |
Bilinmiyor Bilinmiyor Bilinmiyor Metabolik Bilinmiyor
|
Steatojenik Pro-inflamatuar Pro-inflamatuar Steatojenik Pro-inflamatuar; steatojenik
|
| KETİAPİN | İkinci Kuşak Antipsikotik | Fulminan Hepatik Yetmezlik
Kolestazis; Transaminitis Fulminan Hepatik Yetmezlik Kolestatik Hasar |
İdiosenkrotik mekanizma İdiosenkrotik mekanizma Bilinmiyor Bilinmiyor
|
Nekrotik |
| ARİPİPRAZOL | İkinci Kuşak Antipsikotik |
Sitolitik Hepatit Hepatoselüler Hasar
|
İdiosenkrotik mekanizma
Direkt toksik efekt |
Steatojenik
– |
İlaca Bağlı Karaciğer Hasarında Major Patofizyolojik Yolaklar
İlaçlar, doğrudan hepatik toksisitenin yanı sıra doğuştan gelen ve adaptif bağışıklık tepkisi dahil olmak üzere çoklu moleküler mekanizmalar yoluyla karaciğerde hasara neden olabilir. İlaçlar veya metabolitleri, reaktif oksijen radikallerini biriktirerek ve mitokondriyal disfonksiyonu indükleyerek oksidatif stres yoluyla doğrudan hepatik toksisiteye neden olabilir. Ayrıca inflamasyonu ve lipit birikimini tetikleyerek hepatik yapı ve fonksiyonda bozulmalara neden olabilirler.
İlaca Bağlı Karaciğer Hasarında Oksidatif Stres
Oksidatif stres, DILI ile güçlü bir şekilde ilişkilidir. Çeşitli ilaçlar, reaktif oksijen radikaller üretimini ve lipit peroksidasyonunu teşvik ederek ve ayrıca antioksidan seviyelerini azaltarak karaciğerde oksidatif stresi indükler. Karaciğerdeki başlıca reaktif oksijen radikal kaynakları, hepatositlerdeki mitokondri ve CYP450 enzimleridir. Ayrıca, reaktif oksijen radikalleri üretiminin önemli kaynakları, başta Kupffer hücreleri (hepatik makrofajlar) ve nötrofiller olmak üzere bağışıklık hücreleridir. Reaktif oksijen radikalleri, karbonil gruplarını aminoasit yan zincirlerine sokarak protein yapısını ve işlevini etkiler. Ayrıca reaktif oksijen radikalleri, lipit peroksidasyonu sürecinde çoklu doymamış yağ asitlerini oksitleyebilir. Membran çift tabakasındaki lipit peroksidasyonu, membran geçirgenliğini arttırır ve hücre ve organellerin bütünlüğünü bozar. Reaktif oksijen radikalleri ayrıca DNA’nın farklı mutasyon tiplerine ve oksidatif histon modifikasyonlarına neden olabilir ve gen ekspresyon profillerine müdahale ederek DNA metilasyonunu ve DNA ile ilişkili proteinleri etkileyebilir.
Antidepresan İlaçların Karaciğerdeki Pro-Oksidan Etkileri
Beyindeki oksidatif stres, depresyonun patofizyolojisinde önemli bir rol oynar ve antidepresanların antioksidan etkileri, depresyonun remisyonuna neden olabilir. Bununla birlikte, antidepresanların dokuya ve uygulanan doza bağlı olarak antioksidan veya pro-oksidan etkileri olduğu görülmektedir. Bu nedenle, SSRI’lar söz konusu olduğunda, verilerin çoğu beyin dokularında bir antioksidan etkiyi vurgularken, karaciğerde bu ilaçlar esas olarak bir pro-oksidan etki gösterir. Antidepresanların hepatik mitokondri homeostazı ve genel olarak redoks dengesi üzerindeki etkisi, çoğunlukla SSRI olan fluoksetin üzerinde incelenmiştir. 1994 yılında yapılan bir hayvan deneyinde, fluoksetinin yanı sıra ana metaboliti norfluoksetinin izole hepatik mitokondride oksidatif fosforilasyonu bozduğu ve pro-oksidan üretimini artırdığı gösterilmiştir.6 Ayrıca fluoksetin mitokondriyal membranı kolayca geçer ve membrana bağlı proteinlere müdahale ederek proapoptotik olaylara neden olur. Fluoksetine bağlı hepatik oksidatif stres de CYP aracılı metabolizmadan kaynaklanan artan reaktif oksijen radikali üretiminin bir sonucudur. CYP’den türetilen reaktif oksijen radikallerinin makromoleküllerde oksidatif hasara neden olabileceği, mitokondriyal fonksiyonu bozabileceği ve hücre ölümüyle sonuçlanan sinyalleşmeyi tetikleyebileceği bilinmektedir.2,5
Fluoksetin dışındaki SSRI’larla ilgili olarak, sertralin ve sitalopram da oksidatif stres ile ilişkilendirilmiştir. Sertralinin izole hepatik mitokondride oksidatif fosforilasyonu ayırarak mitokondriyal solunum komplekslerini inhibe ettiği gösterilmiştir. TCA’lardan imipramin ve amitriptilinin de sıçan ve fare karaciğerinde reaktif oksijen radikalleri üretimini ve lipit oksidasyonunu arttırdığı gösterilmiştir.2
SNRI’lerle ilgili olarak, venlafaksin ve duloksetinin hepatositlerde oksidatif stresi indüklediği gösterilmiştir. Mitokondri ve lizozomlar, venlafaksin aracılı hücre hasarında birincil hedefler olarak gösterilmektedir. Mitokondriyal disfonksiyon, ilacın kendisi veya CYP450 enzimlerinin aktivitesi yoluyla üretilen reaktif ilaç metaboliti tarafından tetiklenebilir. Duloksetin kullanımında hepatotoksisite, serbest radikalleri veya reaktif oksijen radikallerini serbest bırakabilen hidroksillenmiş ve epoksit metabolitleri tarafından tetiklenen oksidatif stresten kaynaklanabilir.
Antipsikotik İlaçların Karaciğerdeki Pro-Oksidan Etkileri
Klorpromazin kaynaklı hepatotoksisite: son derece reaktif kinon imin metaboliti veren CYP-katalizli yol ile yapılabilen hepatositlerdeki biyoaktivasyonunun veya toksik radikaller oluşturan peroksidaz katalizli oksidasyon sonucudur. Başka bir birinci kuşak antipsikotik olan Haloperidol’ün de sıçan ve fare karaciğerinde glutatyon seviyesini düşürdüğü ve lipit peroksidasyonu yaptığı gösterilmiştir.2
İkinci kuşak antipsikotiklerle ilgili olarak, klozapinin metabolik sendrom ve agranülositozun yanı sıra hepatotoksisite dahil olmak üzere ciddi yan etkilere neden olduğu gösterilmiştir. Klozapinin CYP450 tarafından oksidatif biyoaktivasyonu, yüksek oranda reaktif nitrenyum iyonu, klozapin-N-oksit üretir. Bu reaktif metabolit, reaktif oksijen radikali oluşumuna neden olur, oksidatif stres uygular ve glutatyon aracılı nötralizasyon gerektirir. Yüksek derecede reaktif nitrenyum metabolitinin neden olduğu belirtilen ciddi yan etkiler nedeniyle, klozapin kullanımı kısıtlanmıştır. Nitrenyum iyonu oluşumunu en aza indirgemek için klozapin yapısını modifiye etmek amacıyla tasarlanan başka bir ikinci kuşak antipsikotik: Ketiapin. Bu ilaç şimdiye kadar hepatik oksidatif stres ile ilişkilendirilmemiştir. Sonuçlar aynı zamanda olanzapinin de klozapin gibi hepatik glutatyon aktivitesini, muhtemelen reaktif olanzapin metabolitlerinin eliminasyonuna bağlı olarak arttırdığını ortaya koymuştur.
İlaca Bağlı Karaciğer Hasarında Karaciğer Enflamasyonu
DILI’de bağışıklık tepkisinin aktivasyonu, Kupffer hücreleri, natural killer (NK) ve NK- T hücreleri gibi karaciğerde yerleşik immün hücreler aktivasyonunun yanı sıra lenfositler ve nötrofiller gibi periferik bağışıklık hücrelerinin aktive olmasını da sağlar.
Reaktif ilaç metabolitleri, apopitozu ve nekrozu tetikleyebilir ve hasarlı hücrelerden hasar ilişkili moleküler paternlerin (DAMP) salınması yoluyla bir inflamatuar yanıt başlatabilir. Kupffer hücreleri, DAMP’nin (örneğin, Toll benzeri reseptörler) saptanması için gerekli olan çok sayıda reseptörü eksprese eder ve bu nedenle, enflamatuar sitokinlerin ve kemokinlerin salınımını içerebilen akut hücre hasarına ilk tepkiye aracılık eder. Toll benzeri reseptör ailesi, yalnızca sitokinlerin değil aynı zamanda reaktif oksijen radikallerinin de üretimini destekleyen bir proinflamatuar transkripsiyon faktörü olan nükleer faktör kappa b’yi (NF-κB) aktive eder. Bu nedenle, inflamatuar medyatörlerin ana kaynağı olan aktive edilmiş Kupffer hücreleri, artan sitotoksisite ve kemotaksi gösterir.
Antidepresan İlaçların Karaciğerdeki Proinflamatuar Etkileri
Antidepresan ilaçlar ile ilişkili DILI, patofizyoloji olarak genellikle immüno-alerjik veya metaboliktir. Hepatit, inflamatuar karaciğer hastalığı, TCA ile tedavi edilen hastalarda bildirilmiştir.4 İmipramin ile tedavi edilen bir hastada, lenfositler ve önemli miktarda eozinofil içeren portal alanları olan masif karaciğer nekrozu vakası tanımlanmıştır.2 Mononükleer hücrelerin, nötrofillerin ve eozinofillerin infiltrasyonunun yanı sıra masif nekroz ve yoğun bir inflamatuar reaksiyon ile amitriptilin kaynaklı hepatit de gösterilmiştir.4
SSRI kaynaklı hepatit nadirdir, ancak ciddi olabilir. Birkaç vakada akut hepatit bildirilmiş olmasına rağmen, kronik hepatit nadiren fluoksetin tedavisine bağlanmıştır. Paroksetin ile ilişkili bir hepatit vakasında, orta derecede genişlemiş portal yolları olan, lenfositler ve plazma hücreleri tarafından infiltre edilmiş bir hasta tarif edilmiştir. İlginç bir şekilde, diğer SSRI’lara kıyasla karaciğer için daha az tehlikeli olduğu düşünülen bir ilaç olan sertralin ile tedavi edilen bir hastada ölümcül hepatit rapor edilmiştir. Yazarlar, sertralinin indüklediği hepatitin, karaciğerde in situ üretilen reaktif bir metabolit tarafından kovalent olarak modifiye edilen self-proteinlere karşı immünizasyondan kaynaklandığını öne sürmüşlerdir. Bununla birlikte, sertralinin hepatik CYP450 tarafından geniş ölçüde metabolize edildiği bilinmesine rağmen, reaktif metabolitler henüz tanımlanmamıştır. Ayrıca sertralin ile tedavi edilen başka bir hastada lobüler inflamasyon ve hafif eozinofil hakimiyeti bildirilmiştir.2,4
Yeni nesil antidepresanlardan SNRI’lar nadiren hepatite sebep olmaktadır. Venlafaksin ilişkili hepatit sadece birkaç vakada bildirilmiştir. Yayımlanan ilk vaka günlük 75 mg düşük doz venlafaksin kullanan bir hastadır. Normal teröpatik aralıkta venlafaksin ve trazadon kombinasyonu kullanan bir hastada fulminan karaciğer yetmezliği gösterilmiştir. Venlafaksin alan bir hastada eozinofillerle birlikte karışık portal inflamatuar infiltratları içeren kolestatik hepatit de tanımlanmıştır.2 Duloksetin alan hastalarda hepatit ve kolestatik sarılık raporları 2005 yılının sonlarında ortaya çıkmıştır. 2006 yılında duloksetin ile tedavi edilen bir hastada fulminan karaciğer yetmezliği bildirilmiştir; portal ve lobüler alanlarda, ara sıra eozinofiller ve lenfositler ile esas olarak nötrofillerden oluşan karışık bir inflamatuar infiltrat ile ilişkilendirilmiştir.7
Antipsikotik İlaçların Karaciğerdeki Proinflamatuar Etkileri
Hepatit, haloperidol, klozapin, risperidon, olanzapin, ketiapin ve aripiprazol dahil olmak üzere hem birinci kuşak hem de ikinci kuşak antipsikotikler ile tedavi edilen hastalarda rapor edildiğinden, antipsikotik ilaçlarla ilişkilendirilmiştir (Tablo 2). Küçük bir kısmında ölümcül olan ciddi hepatit vakaları gözlenmiştir. Haloperidol ile indüklenen hepatitli bir hastada portal safra kanalları çevresinde ağırlıklı olarak eozinofiller olmak üzere inflamatuar hücrelerin yoğun infiltrasyonu fark edilmiştir. İkinci kuşak antipsikotikler ile ilgili olarak, klozapin kullanımı sonrası akut nekrotik hepatitin yanı sıra fokal nekrozlu kolestatik hepatit ve eozinofil infiltrasyonu bildirilmiştir. Olanzapin ile tedavi edilen bazı hastalarda hepatosellüler hasar, sentrilobüler nekroz ve mononükleer granülositler, lenfositler ve eozinofiller içeren portal alanlarda infiltratlar gözlenmiştir. Ketiapin tedavisinden sonra spesifik olmayan inflamatuar infiltratlarla birlikte yaygın hepatosit nekrozu bulunmuştur. Son olarak, aripiprazol kullanan bir hastada eozinofili ile portal inflamatuar hücresel reaksiyon bildirilmiştir.
İlaca Bağlı Karaciğer Hasarında Hepatosteatoz
Hepatik steatoz veya yağlı karaciğer, lipit birikimi ve uzaklaştırılması arasındaki dengesizlik nedeniyle hepatositlerde yağın biriktiği geri dönüşümlü bir durumdur. Diyet ve adipoz doku lipolizi veya de novo lipogenezden kaynaklanan yağ asidi akışındaki artış ve β-oksidasyon veya çok düşük yoğunluklu lipoprotein (VLDL) salgılanması yoluyla yağ asidi uzaklaştırılmasındaki azalma, hücre içi lipit damlacıklarına yol açabilir. Belirtilen tüm mekanizmalar, farklı antidepresanlar ve antipsikotiklerin kullanımı ile etkilenebilir.
Steatoz, makroveziküler ve mikroveziküler olmak üzere iki ana formda ortaya çıkar. Makroveziküler steatoz veya makrosteatoz, sitoplazmanın çoğunu dolduran ve çekirdeği hücrenin çevresine kaydıran hepatosit başına tek, büyük bir yağ vakuolü ile karakterize edilir. Makrosteatoz, fibrozis veya siroza nadiren ilerleyen iyi ve uzun vadeli prognoza sahiptir. Öte yandan, yaygın, mikroveziküler steatoz veya mikrosteatoz, sitoplazmada çok sayıda küçük damlacık bulunan genişlemiş hepatositlerden oluşurken, çekirdek merkezi bir konuma sahiptir. Genellikle kronik lipit peroksidasyonu, steatohepatit gelişimi, karaciğer yetmezliği ve ensefalopati ile ilişkilidir ve yaygın veya uzun süreli olduğunda hayatı tehdit edici olabilir.
Antidepresan İlaçların Karaciğerdeki Steatojenik Etkileri
Farklı antidepresan sınıflarının hepatik steatojenik etkileri, hastalarda, hayvan modellerinde ve ayrıca in vitro çalışmalarda gösterilmiştir. Vaka çalışmaları ile ilgili olarak, imipramin tedavisine bağlı orta derecede steatoz bildirilmiştir. 8 hafta boyunca tianeptin aldıktan sonra akut hepatit gelişen bir hastada hepatositlerin %40’ını içeren orta derecede makro ve mikroveziküler yağ birikimi tespit edilmiştir. Son zamanlarda, fluoksetin kaynaklı bir steatoz-hepatomegali vakası tarif edilmiştir. SNRI durumunda, venlafaksin ve ayrıca duloksetin alan hastalarda orta derecede belirgin steatoz tespit edilmiştir. TCA’ların amitriptilin ve imipraminin, hücresel kolesterol ve serbest yağ asitlerinin (FFA’lar) biyosentezinin en önemli düzenleyicileri olan sterol düzenleyici element bağlayıcı proteinlerin (SREBP) aktivasyonunu desteklediği gösterilmiştir. Ayrıca, amitriptilinin steatojenik etkisi sıçan karaciğerinde in vivo olarak gösterilmiştir.2,5
Antipsikotik İlaçların Karaciğerdeki Steatojenik Etkileri
Birçok antipsikotik ilaç, özellikle ikinci kuşak antipsikotikler, steatoz dahil olmak üzere olumsuz metabolik etkilerle güçlü bir şekilde ilişkilidir. Bazı birinci kuşak antipsikotikler, klorpromazinin sıçan karaciğerinde yaptığı gibi steatojenik etkiler gösterse de steatoz öncelikle ikinci kuşaklarla ilişkilidir. Risperidon ile tedavi edilen iki pediatrik hasta vakasında yağlı karaciğer tespit edilmiştir. Her iki vakaya da obezite ve karaciğer enzimlerinin anormal serum seviyeleri eşlik etmektedir. Aşırı kilo alımının eşlik ettiği risperidon ile ilişkili steatohepatit de tanımlanmıştır.
Başta klozapin ve olanzapin olmak üzere ikinci kuşak antipsikotikler ve daha az ölçüde ketiapin, risperidon ve aripiprazol kilo artışını, insülin direncini ve metabolik sendromu tetikleyebilir. Tüm bu metabolik bozukluklar karaciğer lipogenezini teşvik eder ve daha sonra yağlı karaciğer ve steatohepatite yol açabilir. İnsülin direnci, sırasıyla periferik dokular tarafından glikoz alımının azalması ve telafi edici hiperinsülinemi nedeniyle hepatositleri aşırı glikoz ve insülin yüküne maruz bırakır. Ortaya çıkan hiperglisemi ve hiperinsülinemi de novo lipogenezi teşvik edebilir. Ayrıca, insülin, ana VLDL protein kofaktörü olan apolipoprotein B’nin (apoB) sentezini baskılayarak, VLDL yoluyla hepatik lipitlerin klirensini azaltır. Bu nedenle, yüksek insülin seviyeleri, VLDL aracılı lipit sekresyonunu bloke ederek hepatik trigliserit seviyelerini daha da arttırır.
Sonuç
Bu yazımızdan akılda kalması gereken antidepresan ve antipsikotiklerin büyük bir kısmı terapötik dozda dahi olsa potansiyel olarak hepatotoksik olduğudur. Antidepresan- antipsikotik ilişkili DILI multipl moleküler mekanizmalar sonucu ortaya çıkabilir; ilaç metabolizmasına bağlı yan reaksiyonlar veya metabolitler, hepatik oksidatif stres, inflamasyon, yağlanma. Bu ilaçlara bağlı hepatotoksisite fark edilmeli ve dikkatli yönetilmelidir. Çoklu ilaç kullanımında veya ilaç metabolizmasının yavaşladığı durumlarda bu ilaçlar karaciğer hasarı için potansiyel risk taşır. Hepatotoksisite riski yüksek antidepresan ve antipsikotik kullanımında karaciğer enzim değerleri rutin takip edilmelidir. Bu ilaçlar, hikayesinde karaciğer hastalığı olanlarda, yaşlı hastalarda, alkol ve madde bağımlılarında tercih edilmemelidir. Ek tedavi planlanırken klinisyen yarar-zarar ilişkisini gözetmelidir. Risk gruplarında kişiselleştirilmiş tedaviler tercih edilmelidir. Sonuç olarak hastalar bu ilaçların olası karaciğer yan etkileri ve oluşabilecek semptomlar hakkında bilgilendirilmeli ve doktora başvurması söylenmelidir.
KAYNAKLAR
- Abboud G, Kaplowitz N. Drug-induced liver injury. Drug safety. 2007;30(4):277-94.
- Todorović Vukotić N, Đorđević J, Pejić S, Đorđević N, Pajović SB. Antidepressants-and antipsychotics-induced hepatotoxicity. Archives of Toxicology. 2021;95(3):767-89.
- Licata A, Minissale MG. Weight-loss supplementation and acute liver failure: the case of Garcinia Cambogia. Internal and Emergency Medicine. 2018;13(6):833-5.
- Selim K, Kaplowitz N. Hepatotoxicity of psychotropic drugs. Hepatology. 1999;29(5):1347-51.
- García-Pando AC, del Pozo JG, Sánchez AS, Martin AV, de Castro AR, Lucena MI. Hepatotoxicity associated with the new antidepressants. Journal of Clinical Psychiatry. 2002;63(2):135-7.
- Souza MEJ, Polizello ACM, Uyemura SA, Castro-Silva Jr O, Curti C. Effect of fluoxetine on rat liver mitochondria. Biochemical pharmacology. 1994;48(3):535-41.
- Hanje AJ, Pell LJ, Votolato NA, Frankel WL, Kirkpatrick RB. Case report: fulminant hepatic failure involving duloxetine hydrochloride. Clinical Gastroenterology and Hepatology. 2006;4(7):912-7.