Uzun zamandır geniş bir tedavi spektrumunda kullandığımız antikolinerjik ilaçların artan kırık riski ile ilişkisi tartışılmaya devam eden bir konudur. Bu yazımızda Ogawa ve arkadaşlarının “Journal of Pharmaceutical Health Care and Sciences” dergisinde yayınlanan “A meta-analysis of observational studies on anticholinergic burden and fracture risk: evaluation of conventional burden scales” isimli, dört antikolinerjik yük ölçeğini kullanarak, antikolinerjik ilaçlar ile kırık riski arasındaki ilişkiyi değerlendiren, kohort çalışmaları veya vaka kontrol çalışmalarından derledikleri meta analizi size sunmaya gayret edeceğim.
Antikolinerjik ilaçlar, merkezi ve periferik sinir sistemlerindeki muskarinik reseptörlere bağlanarak asetilkolin aracılı cevabı inhibe eder. Bu ilaçların kullanımı yıllar içerisinde artış göstermiştir [1]. Antikolinerjik ilaçlar, psikotrop ilaçlar, antiparkinson ilaçlar, aşırı-aktif mesane ilaçları ve bazı antiaritmik ilaçlar (disopiramid gibi) dahil olmak üzere geniş bir fizyolojik etki spektrumuna sahip ilaçları içerir. Bu nedenle, birden fazla doktordan reçete alan hastalarda, antikolinerjik ilaçların birlikte kullanılması nedeniyle potansiyel olarak artan antikolinerjik yük vardır.
Daha önceki bazı çalışmalarda [2–4], olanzapin ve paroksetin kullananların, kullanmayanlara göre sırasıyla 1.49 kat ve 1.21 kat daha yüksek kırık riskine sahip olduğu tespit edilmiştir. Diğer yandan antikolinerjik ilaçların önemli bir kırık riski ile ilişkisinin olmadığını belirten çalışmalar da mevcuttur [5,6]. Bu nedenle antikolinerjik ilaç kullanımının kırık riskini artırıp artırmadığı konusu tartışmalıdır.
Antikolinerjik yükü belirlemek için antikolinerjik risk ölçeği (ARS) [7], antikolinerjik bilişsel yük (ACB) [8,9], antikolinerjik ilaç ölçeği (ADS) [10] ve ilaç yükü indeksi-antikolinerjik bileşen (DBIAch) [11] ölçekleri geliştirilmiştir. Birçok çalışmada bu ölçekler kullanılarak ölçülen antikolinerjik yük ile düşmeye bağlı kırıklar arasındaki ilişki bildirilmiş, ancak kırıklar üzerindeki antikolinerjik etkinin doğrudan nedensel mekanizması bugüne kadar kanıtlanamamıştır [12–14]. Reinold ve ark. [14], ARS kullanan çalışmalarda antikolinerjik yük ve olası doza maruziyet gradyanı ile artan kırık riski arasında bir ilişki olduğunu göstermişse de ACB, ADS ve DBI-Ach gibi diğer antikolinerjik yük ölçekleri ile kırık riski arasındaki ilişki hala belirsizdir.
ARS, ACB, DBI-Ach ve ADS antikolinerjik yükü değerlendirmek için yaygın olarak kullanılan ölçeklerdir. ARS’de ilaçlar 0 (antikolinerjik yan etki riski yok veya düşük) ile 3 (yüksek potansiyel risk) arasında derecelendirilir. ACB’de, olası antikolinerjik etkileri olan ilaçlar, 1’den (klinik olarak anlamlı olumsuz bilişsel etkiler bilinmiyor) 3’e (klinik olarak anlamlı olumsuz bilişsel etkiler) kadar derecelendirilir. ADS, ilaçların antikolinerjik etkilerini 0’dan (bilinen antikolinerjik aktivite yok) 3’e (önemli ölçüde belirgin antikolinerjik aktivite) 4 puanlık bir ölçekte sıralar. Bu antikolinerjik yük ölçeklerinin (ARS, ACB ve ADS) her birinde bir birey için toplam antikolinerjik ilaca maruz kalma, tüm ilaçların puanlarının toplamıdır. ACB ve ARS için kullanılan ilaçların puanları Ek Dosya 1’de gösterilmiştir. DBI ise hem antikolinerjik (DBI-Ach) hem de yatıştırıcı ilaçlara maruziyeti hesaplayan farmakolojik bir risk değerlendirme aracıdır. DBI, kümülatif maruz kalma ve doz yanıtı ilkesine dayanmaktadır.
Ogawa ve arkadaşları bu çalışmada, yaygın olarak kullanılan dört antikolinerjik yük ölçeği (ARS, ACB, ADS ve DBI-Ach.) kullanılarak ölçülen antikolinerjik ilaç yükü ile kırık riski arasındaki ilişkiyi açıklamayı amaçlayan bir meta-analiz yapmışlar.
Meta-analizde kullanılacak çalışmaların taranmasında PubMed (1966 – Mart 2021), Cochrane Library (1974 – Mart 2021), Scopus (1970 – Mart 2021) ve Ichushi-web (1983 – Mart 2021) kullanılmış ve bu veritabanlarında “antikolinerjik”, “ilaç yükü indeksi”, “kolinerjik antagonistler”, “kırık” ve “kırıklar, kemik” gibi MeSH terimleri veya anahtar sözcükleri kullanılarak 327 çalışma bulunmuş. Araştırmacılar tarafından dahil etme/hariç tutma kriterlerine göre bu çalışmalardan 10’u meta analizde kullanılmaya uygun bulunmuştur [12,13,15–22], (Tablo 1 ve Tablo 2).
Tablo 1. Mevcut meta-analizde yer alan kohort çalışmalarının özellikleri
| Çalışma | Ülke | Örneklem büyüklüğü (AC ilaç kullananlar, (n)) | Kadın (%) | Yaş | Anatomik kırık bölgesi | AC yükü ölçeği | Ortalama takip |
| Bali ve ark.
(2016) [15] |
Amerika | 9240
(4620) |
67 | ≥65 | Kalça | ARS,
ACB, ADS |
2.0 yıl |
| Crispo ve ark. (2016)
[16] |
Kanada | 16,302
(13,839) |
47 | ≥70 | Herhangi bölge | ARS | 3–6 gün: 2463 kişi 7–30 gün: 5799 kişi ≥31 gün: 141 kişi |
| Hsu ve ark.
(2017) [13] |
Tayvan | 116,043
(43,301) |
50 | ≥65 | Herhangi bölge | ARS,
ACB, DBI-Ach |
8.3 yıl |
| Ishida
ve ark.. (2019) [17] |
Amerika | 60,007
(3745) |
56 | ≥65 | Kalça, femur, pelvis, ayak, kol, el veya aksiyal iskelet | ACB | 243 gün |
| Kao ve ark.
(2018) [18] |
Tayvan | 14,635
(2927) |
69 | 52.0± 16.9
(çalışma grubu), 51.9± 17.1 (kontrol) |
Herhangi bölge | ACB | 3.0 yıl |
| Lu ve ark.
(2015) [19] |
Tayvan | 59,042
(7461) |
49 | ≥65 | Herhangi bölge | ARS | 7.95 ± 3.03 yıl |
| Moga
ve ark. (2013) [21] |
Amerika | 6594
(1125) |
4 | ≥65 | Kalça veya herhangi bölge | ARS,
ACB, ADS |
AC kullananlar: 49 gün (medyan), AC kullanmayanlar: 95 gün (medyan) |
| Sørensen
ve ark. (2013) [22] |
Danimarka | 2224
(1216) |
Belirtilmemiş | 68.6 ± 12.8 | Kalça | ARS,
ACB, ADS |
Belirtilmemiş |
Tablo 2. Mevcut meta-analizde yer alan vaka kontrol çalışmalarının özellikleri
| Çalışma | Ülke | Örneklem büyüklüğü (vaka/kontrol) | Kadın (%) | Yaş | Anatomik kırık bölgesi | AC yükü ölçeği | AC kullanım süresi |
| Chatterjee
ve ark. (2016) [12] |
Amerika | 202260
(40452/161808) |
81.1 ± 7.4 | 85 | Kalça veya femur | ADS | Kırıktan 30-90 gün önce reçete edilmiş |
| Machado-
Duque ve ark. (2018) [20] |
Kolombiya | 900
(300/600) |
81.6 ± 8.9 | 71 | Kalça | ARS | Kırıktan 30 gün önce reçete edilmiş |
Bu çalışmada, antikolinerjik yükü değerlendirmek için hangi antikolinerjik yük ölçeğinin kullanıldığına bakılmaksızın, antikolinerjik ilaç kullanıcılarının, kullanmayanlara kıyasla kırık riskinin önemli ölçüde %19 ila 49 oranında arttığı bulunmuştur. Ancak ilginç bir şekilde antikolinerjik yük ile kırık riski arasındaki ilişki, kullanılan antikolinerjik yük ölçeğine bağlı olarak farklı eğilimler göstermiştir.
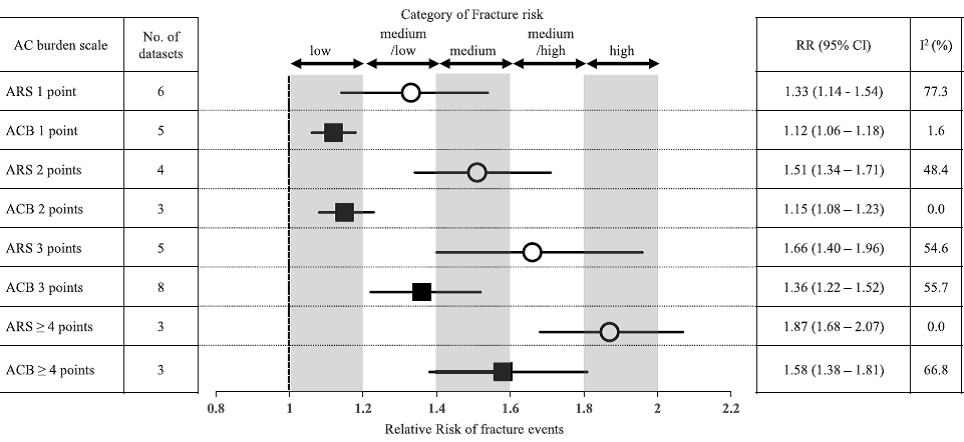
ARS kullanan çalışmalarda olduğu kadar DBI-Ach kullanan tek bir çalışmada da kırık riskinin doza bağlı olarak arttığı gösterilmiştir. ACB ise diğer antikolinerjik yük ölçeklerinden farklı bir eğilim sergilemektedir. ACB kullanırken, yüksek antikolinerjik yük (3 veya 4 puan), düşük antikolinerjik yükten (1 veya 2 puan) daha yüksek kırık riski ile ilişkili olmasına rağmen, kırık oranı ACB 1 puan ile 2 puan arasında farklılık göstermemektedir (RR: 1.12 ve 1.15, sırasıyla) (Şekil 1).
Dahil edilen çalışmalarda antikolinerjik yükü hesaplamak için yaygın olarak ARS ve ACB kullanıldığından dolayı yazarlar, aynı kohortu kullanarak, antikolinerjik yükü ölçmek için ARS ve ACB ölçekleri ile kırık riskinin farklılık gösterip göstermediğini incelemişler.
Meta-analizlerin sonuçlarına göre kırık riski “düşük” ile “yüksek” arasında değişen beş kategoriye ayrılmış (Şekil 1). ACB 1 puanı ve ACB 2 puanlarının her ikisi de “düşük” kırık riski ile ilişkili bulunmuş. ARS için ise kırık riski puan artışına göre progresyon göstermektedir. Daha eski tarihli bir çalışmada, hastaların yaklaşık yarısının ARS ve ACB dahil farklı ölçekler tarafından aynı yük kategorisine sınıflandırıldığını ve kullanılan değerlendirme ölçeğine bağlı olarak antikolinerjik yük seviyesinin değiştiğini bildirilmiştir [23]. Bu meta analizde ise ARS 1 puanı ve ACB 3 puanlarının her ikisi de “orta/düşük” kırık riski ile ilişkili bulunmuş olup gruplar benzer sonuçlar göstermemekteydi. Bu noktada ölçeklerin geliştirildiği farklı metodolojinin, kırık riski tahmininde tutarsızlığa yol açtığı düşünülebilir. ARS, düşme, ağız kuruluğu, kuru gözler, baş dönmesi ve kafa karışıklığı gibi antikolinerjik yan etki riskini tahmin etmek için geliştirilmiştir [7]. ACB ise bilişsel bozulma riskini öngörmek için geliştirilmiştir [9,10].
Hem ARS hem de ACB’ye dahil edilen 35 ilaçtan 22’si uyumlu ARS-ACB skorlarına sahipken, bu ilaçların hiçbiri kırık riski kategorisinde uyumlu değildir (Ek Dosya 1). Öte yandan, aynı kırık riski kategorisinde yer alan üç ilaç (metokabamol, paroksetin ve ketiapin) ARS ve ACB’de farklı puanlara sahiptir.
Şekil 1. Hem ARS hem de ACB kullanarak antikolinerjik yükü ölçen dört çalışmayı içeren meta-analiz sonuçlarının özeti
Genel olarak yaşlı kişilerde hepatik ve renal klirensin azalması gibi farmakokinetik değişiklikler ve antikolinerjik ilaçlara duyarlılığın artması gibi farmakodinamik değişiklikler meydana gelir. Bu meta-analizde de 65 yaş ve üzeri hasta alt grubunda, antikolinerjik ilaç kullananların, antikolinerjik ilaç kullanmayanlara göre, kullanılan antikolinerjik yük ölçeğinden bağımsız olarak kırık riskinin arttığını gösterilmiştir. Antikolinerjik ilaçların tipik bir sınıfı olan psikotropların düşmelere neden olduğu iyi bilinmektedir [24]. Bu analizin sonuçları da antikolinerjik ilaçların sadece düşme riskini değil aynı zamanda kırık riskini de artırabileceğini göstermektedir.
Sonuç olarak antikolinerjik ilaç kullanımı genel olarak kırık riskini artırır. Yük arttıkça kırık riskinin arttığı da görülmektedir. Ancak antikolinerjik yük ile kırık riski arasındaki ilişki kullanılan antikolinerjik yük ölçeğine göre farklılık gösterebilir. Meta analizin sonuç önerisi sağlık profesyonellerinin kırık riskini önlemek için reçete edilen antikolinerjik ilaçları, her ilaç için kapsamlı bir şekilde değerlendirmeleri yönündedir.
Ek Dosya 1. Hem ARS hem de ACB’ye dahil edilen otuz beş ilaç.
| Drug name | Concordance between ARS and ACB scores | ARS
(points) |
ACB
(points) |
Concordance in fracture risk between ARS and ACB | Fracture risk category using ARS | Fracture risk category using ACB |
| Amantadine | ✓ | 2 | 2 | – | medium | low |
| Amitriptyline | ✓ | 3 | 3 | – | medium/high | medium/low |
| Atropine | ✓ | 3 | 3 | – | medium/high | medium/low |
| Benztropine* | ✓ | 3 | 3 | – | medium/high | medium/low |
| Chlorpheniramine | ✓ | 3 | 3 | – | medium/high | medium/low |
| Chlorpromazine | ✓ | 3 | 3 | – | medium/high | medium/low |
| Cyclobenzaprine* | ✓ | 2 | 2 | – | medium | low |
| Dicyclomine | ✓ | 3 | 3 | – | medium/high | medium/low |
| Diphenhydramine | ✓ | 3 | 3 | – | medium/high | medium/low |
| Haloperidol | ✓ | 1 | 1 | – | medium/low | low |
| Hydroxyzine | ✓ | 3 | 3 | – | medium/high | medium/low |
| Hyoscyamine* | ✓ | 3 | 3 | – | medium/high | medium/low |
| Imipramine | ✓ | 3 | 3 | – | medium/high | medium/low |
| Meclizine | ✓ | 3 | 3 | – | medium/high | medium/low |
| Oxybutynin | ✓ | 3 | 3 | – | medium/high | medium/low |
| Perphenazine | ✓ | 3 | 3 | – | medium/high | medium/low |
| Promethazine | ✓ | 3 | 3 | – | medium/high | medium/low |
| Ranitidine | ✓ | 1 | 1 | – | medium/low | low |
| Risperidone | ✓ | 1 | 1 | – | medium/low | low |
| Thioridazine* | ✓ | 3 | 3 | – | medium/high | medium/low |
| Trazodone | ✓ | 1 | 1 | – | medium/low | low |
| Trifluoperazine | ✓ | 3 | 3 | – | medium/high | medium/low |
| Cetirizine | – | 2 | 1 | – | medium | low |
| Cimetidine | – | 2 | 1 | – | medium | low |
| Clozapine | – | 2 | 3 | – | medium | medium/low |
| Cyproheptadine | – | 3 | 2 | – | medium/high | low |
| Desipramine* | – | 2 | 3 | – | medium | medium/low |
| Loperamide | – | 2 | 1 | – | medium | low |
| Loratadine | – | 2 | 1 | – | medium | low |
| Methocarbamol | – | 1 | 3 | ✓ | medium/low | medium/low |
| Nortriptyline | – | 2 | 3 | – | medium | medium/low |
| Olanzapine | – | 2 | 3 | – | medium | medium/low |
| Paroxetine | – | 1 | 3 | ✓ | medium/low | medium/low |
| Quetiapine | – | 1 | 3 | ✓ | medium/low | medium/low |
| Tolterodine | – | 2 | 3 | – | medium | medium/low |
AC: Antikolinerjik, ACB: antikolinerjik bilişsel yük ölçeği, ARS: antikolinerjik risk ölçeği, *Japonya’da kullanılmamaktadır.
Kaynaklar
[1] Sumukadas D, McMurdo MET, Mangoni AA, Guthrie B. Temporal trends in anticholinergic medication prescription in older people: repeated cross-sectional analysis of population prescribing data. Age Ageing 2014;43:515–21. https://doi.org/10.1093/ageing/aft199.
[2] Lee S-H, Hsu W-T, Lai C-C, Esmaily-Fard A, Tsai Y-W, Chiu C-C, et al. Use of antipsychotics increases the risk of fracture: a systematic review and meta-analysis. Osteoporos Int 2017;28:1167–78. https://doi.org/10.1007/s00198-016-3881-3.
[3] Vestergaard P, Rejnmark L, Mosekilde L. Selective Serotonin Reuptake Inhibitors and Other Antidepressants and Risk of Fracture. Calcif Tissue Int 2008;82:92–101. https://doi.org/10.1007/s00223-007-9099-9.
[4] Yehoshua A, Chancellor M, Vasavada S, Malone DC, Armstrong EP, Joshi M, et al. Health Resource Utilization and Cost for Patients with Incontinent Overactive Bladder Treated with Anticholinergics. J Manag Care Spec Pharm 2016;22:406–13. https://doi.org/10.18553/jmcp.2016.22.4.406.
[5] Nurminen J, Puustinen J, Piirtola M, Vahlberg T, Lyles A, Kivelä S-L. Opioids, antiepileptic and anticholinergic drugs and the risk of fractures in patients 65 years of age and older: a prospective population-based study. Age Ageing 2013;42:318–24. https://doi.org/10.1093/ageing/afs178.
[6] Vestergaard P, Rejnmark L, Mosekilde L. Fracture Risk Associated with Parkinsonism and Anti-Parkinson Drugs. Calcif Tissue Int 2007;81:153–61. https://doi.org/10.1007/s00223-007-9065-6.
[7] Rudolph JL, Salow MJ, Angelini MC, McGlinchey RE. The anticholinergic risk scale and anticholinergic adverse effects in older persons. Arch Intern Med 2008;168:508–13. https://doi.org/10.1001/archinternmed.2007.106.
[8] Boustani M, Campbell N, Munger S, Maidment I, Fox C. Impact of anticholinergics on the aging brain: a review and practical application. Aging Health 2008;4:311–20. https://doi.org/10.2217/1745509X.4.3.311.
[9] Campbell NL, Maidment I, Fox C, Khan B, Boustani M. The 2012 update to the anticholinergic cognitive burden scale: 2013 AGS annual scientific meeting. J Am Geriatr Soc 2013;61:S142–3. https://doi.org/10.1111/jgs.2013.61.issue-s1.
[10] Carnahan RM, Lund BC, Perry PJ, Pollock BG, Culp KR. The Anticholinergic Drug Scale as a Measure of Drug-Related Anticholinergic Burden: Associations With Serum Anticholinergic Activity. J Clin Pharmacol 2006;46:1481–6. https://doi.org/10.1177/0091270006292126.
[11] Hilmer SN, Mager DE, Simonsick EM, Cao Y, Ling SM, Windham BG, et al. A drug burden index to define the functional burden of medications in older people. Arch Intern Med 2007;167:781–7. https://doi.org/10.1001/archinte.167.8.781.
[12] Chatterjee S, Bali V, Carnahan RM, Chen H, Johnson ML, Aparasu RR. Anticholinergic Medication Use and Risk of Fracture in Elderly Adults with Depression. J Am Geriatr Soc 2016;64:1492–7. https://doi.org/10.1111/jgs.14182.
[13] Hsu W-H, Wen Y-W, Chen L-K, Hsiao F-Y. Comparative Associations Between Measures of Anti-cholinergic Burden and Adverse Clinical Outcomes. Ann Fam Med 2017;15:561–9. https://doi.org/10.1370/afm.2131.
[14] Reinold J, Schäfer W, Christianson L, Barone-Adesi F, Riedel O, Pisa FE. Anticholinergic Burden and Fractures: A Systematic Review with Methodological Appraisal. Drugs Aging 2020;37:885–97. https://doi.org/10.1007/s40266-020-00806-6.
[15] Bali V, Chatterjee S, Johnson ML, Chen H, Carnahan RM, Aparasu RR. Comparative risk of hip fractures in elderly nursing home patients with depression using paroxetine and other selective serotonin reuptake inhibitors. J Comp Eff Res 2016;5:461–73. https://doi.org/10.2217/cer-2016-0009.
[16] Crispo JAG, Willis AW, Thibault DP, Fortin Y, Hays HD, McNair DS, et al. Associations between Anticholinergic Burden and Adverse Health Outcomes in Parkinson Disease. PLOS ONE 2016;11:e0150621. https://doi.org/10.1371/journal.pone.0150621.
[17] Ishida JH, McCulloch CE, Steinman MA, Grimes BA, Johansen KL. Psychoactive Medications and Adverse Outcomes among Older Adults Receiving Hemodialysis. J Am Geriatr Soc 2019;67:449–54. https://doi.org/10.1111/jgs.15740.
[18] Kao L-T, Huang C-Y, Lin H-C, Chu C-M. No Increased Risk of Fracture in Patients Receiving Antimuscarinics for Overactive Bladder Syndrome: A Retrospective Cohort Study. J Clin Pharmacol 2018;58:727–32. https://doi.org/10.1002/jcph.1067.
[19] Lu W-H, Wen Y-W, Chen L-K, Hsiao F-Y. Effect of polypharmacy, potentially inappropriate medications and anticholinergic burden on clinical outcomes: a retrospective cohort study. CMAJ Can Med Assoc J J Assoc Medicale Can 2015;187:E130–7. https://doi.org/10.1503/cmaj.141219.
[20] Machado-Duque ME, Castaño-Montoya JP, Medina-Morales DA, Castro-Rodríguez A, González-Montoya A, Machado-Alba JE. Drugs With Anticholinergic Potential and Risk of Falls With Hip Fracture in the Elderly Patients: A Case–Control Study. J Geriatr Psychiatry Neurol 2018;31:63–9. https://doi.org/10.1177/0891988718757370.
[21] Moga DC, Carnahan RM, Lund BC, Pendergast JF, Wallace RB, Torner JC, et al. Risks and Benefits of Bladder Antimuscarinics Among Elderly Residents of Veterans Affairs Community Living Centers. J Am Med Dir Assoc 2013;14:749–60. https://doi.org/10.1016/j.jamda.2013.03.008.
[22] Sørensen HJ, Jensen SOW, Nielsen J. Schizophrenia, antipsychotics and risk of hip fracture: A population-based analysis. Eur Neuropsychopharmacol 2013;23:872–8. https://doi.org/10.1016/j.euroneuro.2013.04.002.
[23] Pont LG, Nielen JTH, McLachlan AJ, Gnjidic D, Chan L, Cumming RG, et al. Measuring anticholinergic drug exposure in older community-dwelling Australian men: a comparison of four different measures. Br J Clin Pharmacol 2015;80:1169–75. https://doi.org/10.1111/bcp.12670.
[24] Woolcott JC, Richardson KJ, Wiens MO, Patel B, Marin J, Khan KM, et al. Meta-analysis of the impact of 9 medication classes on falls in elderly persons. Arch Intern Med 2009;169:1952–60. https://doi.org/10.1001/archinternmed.2009.357.